Les traitements de la DE post PR (dysfonction érectile post-prostatectomie radicale) ont pour objectif de permettre un rapport sexuel satisfaisant et d’oxygéner les tissus caverneux pour éviter la fibrose pénienne et favoriser le retour d’érections spontanées. En ce sens, ils sont considérés comme une véritable rééducation sexuelle. On estime que la récupération de la fonction érectile peut se faire jusqu’à quatre ans après l’intervention (Glickman, Godoy et al. 2009).
Les trois traitements les plus communément utilisés sont les inhibiteurs de la phosphodiestérase de type 5 (iPDE5), les injections intracaverneuses ou intraurétrales de drogues vasoactives et l’utilisation d’une pompe à vide (vacuum). Ces traitements peuvent avoir une action synergique et leur association est conseillée dans le but d’obtenir des érections optimales. En cas d’échec, la mise en place d’un implant pénien peut être proposée. Dans tous les cas, la prise en charge de la DE post-PR doit être à l’écoute des besoins du couple et apporter un soutien psychologique. En effet, la survenue brutale de la DE dans un contexte de cancer constitue généralement un bouleversement dans la vie du couple et l’approche thérapeutique doit être initiée avant même la PR, lors de la consultation d’annonce du cancer. Il est maintenant clairement établi que le suivi prolongé des patients et l’implication du partenaire sont des facteurs déterminants d’observance et d’efficacité des traitements (Titta, Tavolini et al. 2006).
1) Les inhibiteurs de la phosphodiestérase de type 5 (iPED5)
Les iPED5 sont en passe de devenir le traitement de référence de la DE post PR bien que des controverses persistent au sujet de leur efficacité réelle et de la manière de les administrer. La plupart des études s’accordent néanmoins sur leur absence d’efficacité en cas de non-préservation des bandelettes neuro-vasculaires (Zagaja, Mhoon et al. 2000; Montorsi, Briganti et al. 2004).
Les principales molécules disponibles sont le sildénafil, vardenafil, tadalafil et l'avanafil. Ces médicaments agissent en inhibant la phosphodiestérase de type 5 dont le rôle naturel est de dégrader le GMPc (guanosine mono phosphate cyclique) agissant comme second messager dans le processus de relaxation des cellules musculaires lisses.
La molécule la plus étudiée jusqu’à présent dans le cadre de la DE post-PR est le sildénafil (Viagra). Il a été montré qu’une prise quotidienne de sildénafil au coucher facilitait le retour des érections nocturnes et améliorait ainsi l’oxygénation des corps caverneux (Montorsi, Briganti et al. 2004). Par ailleurs, le sildénafil pourrait avoir un effet protecteur sur l’endothélium (Behr-Roussel, Oudot et al. 2008) et les cellules musculaires lisses des espaces sinusoïdes (Schwartz, Wong et al. 2004). Chez le rat, l’administration chronique et quotidienne de sildénafil à faible dose augmente la réponse érectile déclenchée ultérieurement par la prise d’une forte dose (Behr-Roussel, Oudot et al. 2008), témoignant d’une amélioration progressive de l’efficacité des iPED5 en prise continue. La prise quotidienne de sildénafil a ainsi été associée au concept de prophylaxie pharmacologique ou de réhabilitation sexuelle passive visant à accélérer le retour des érections naturelles après PR (Montorsi, Briganti et al. 2004).
Cependant, le taux réel de retour à une activité sexuelle avec iPED5 après PR reste controversé. Ainsi il a été montré que les effets du sildénafil sont insuffisants permettre un rapport sexuel durant les neufs premiers mois post opératoires (Zagaja, Mhoon et al. 2000). Il y aurait un délai entre la PR et le début de l’efficacité clinique des iPDE5 correspondant à la période de régénération des nerfs caverneux et à la restitution d’une fonction nNOS intra-caverneuse. Certains auteurs ont donc préconisé la prise d’autres traitements à efficacité immédiate comme les injections intra-caverneuses de prostaglandine pendant les premiers mois post opératoires puis d’introduire les iPDE5 à la réapparition d’érections naturelles (Montorsi, Briganti et al. 2004).
Récemment, un essai clinique multicentrique randomisé contre placebo a évalué un autre iPDE5 (vardénafil) chez des patients opérés d’une PR avec préservation bilatérale des nerfs caverneux (Montorsi, Brock et al. 2008). Le traitement était débuté un mois après la PR en prise quotidienne (groupe 1) ou à la demande (groupe 2), c’est à dire avant chaque rapport. Après 9 mois de traitement, les patients recevaient un placebo pendant deux mois puis du vardénafil à la demande pendant 2 mois. Contre toute attente, le groupe de patients ayant pris initialement le traitement à la demande était celui qui avait les meilleurs résultats en terme de normalisation de la fonction érectile et de satisfaction des rapports sexuels. Les taux de normalisation de la fonction érectile (score IIEF>22) à neuf mois dans les groupes placebo, prise en continu (groupe 1) et à la demande (groupe 2) étaient respectivement de 24,8% 32,0% et 48.2%. Ces résultats suggèrent donc que la prise d’iPDE5 avant chaque rapport sexuel constitue le mode de prescription optimale. Cette notion peut apparaître en contradiction avec les résultats des études citées plus haut et montrant les effets bénéfiques de la prise de sildénalfil de manière quotidienne.
Par ailleurs, il important de souligner que les essais cliniques testant les iPDE5 impliquent un suivi régulier des patients et la dispensation du médicament qui n’est pas remboursé par l’Assurance Maladie. La prescription d’iPDE5 en pratique courante reste problématique en raison du coût et de l’absence d’efficacité immédiate. Ainsi, Salonia et al. (Salonia, Gallina et al. 2008) ont montré que 73% des patients chez qui un iPDE5 était prescrit sans suivi abandonnaient le traitement en raison du manque d’efficacité.
2) Les injections de drogues vasoactives
Les injections intra-caverneuses (IIC) de drogues vaso-actives (prostaglandines E1, PGE1 ou alprostadil, nom commercial: Edex) restent le traitement le plus souvent prescrit en France pour la prise en charge de la DE post-PR (Giuliano, Amar et al. 2008). Les principales raisons sont le remboursement du médicament par l’Assurance maladie et son efficacité immédiate permettant à la fois un retour rapide de l’activité sexuelle (Montorsi, Guazzoni et al. 1997; Titta, Tavolini et al. 2006). L’administration chronique de PGE1 pourrait favoriser le retour des érections naturelles (Montorsi, Guazzoni et al. 1997) et avoir un effet trophique sur les tissus caverneux en améliorant notamment les paramètres dopplers de la vascularisation pénienne (Brock, Tu et al. 2001). Afin d’éviter la fibrose des corps caverneux après PR, l’introduction des IIC est préconisée avant le 3ème mois post-opératoire (Gontero, Fontana et al. 2003). Cependant, l'acceptabilité et l'observance de cette thérapeutique à long terme restent médiocres du fait de la pénibilité du traitement et des douleurs occasionnées (Weiss, Badlani et al. 1994; Kim, Lee et al. 1997; de la Taille, Delmas et al. 1999). Actuellement, les IIC de PGE1 trouvent leur principale indication chez les patients ayant eu une PR non conservatrice des nerfs caverneux ou ne réagissant pas aux iPDE5. Les principaux effets secondaires sont la survenue d’un priapisme ou de nodules péniens au site d’injection voire de véritables maladie de Lapeyronie. Il n’y a pas vraiment de contre indication aux IIC en dehors de certaines hémopathies et d’antécédents de priapisme. En particulier, la prise d’anticoagulants nécessite des précautions particulières mais ne constitue pas une contre indication.
En raison des douleurs occasionnées par les IIC de PGE1, certains ont proposés d’y associer un antalgique (Schramek, Plas et al. 1994) ou d’autres agents vaso-actifs réputés moins douloureux comme Trimix combinant PGE1/papavérine/phentolamine (Mulhall, Land et al. 2005). Cependant, ce mélange utilisé aux Etats Unis n’a pas d’autorisation de mise sur le marché en France ; par conséquent, sa prescription ne peut se faire que dans un cadre réglementé.
Les injections intra urétrale de prostaglandines constituent une alternative aux injections intra-caverneuses (Raina, Pahlajani et al. 2007). Cependant, ce traitement reste peu prescrit en France, en raison de son coût, sa moindre efficacité et des douleurs urétrales associées. Récemment, une nouvelle forme d'alprostadil associée à une substance permettant sa diffusion à travers la peau et les muqueuses a été mise sur le marché (Vitaros). Cette crème doit être appliquée à l'extrémité du pénis, au niveau du méat urétral. Elle agit en 5 à 30 minutes et permet une érection pendant 1 à 2 heures, de manière variable selon les patients. Il manque actuellement d'études comparatives avec les autres traitements pour juger de l'efficacité réelle du Vitaros, cependant, ce nouveau traitement pourrait constituter une avancée dans la prise en charge de la DE. Consulter ici la fiche Vidal du médicament.
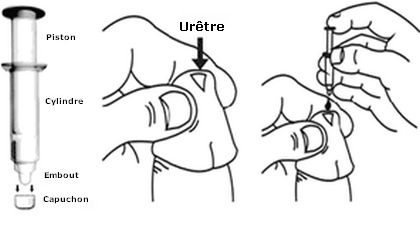 Utilisation du Vitaros
Utilisation du Vitaros
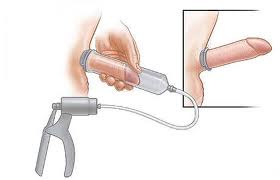
3) Le vacuum
La pompe à vide (vacuum) représente la troisième approche thérapeutique conservatrice de la DE post PR. Ce dispositif médical entraine une érection par un afflux de sang veineux dans les corps caverneux grâce à la dépressurisation du tube dans lequel le pénis est introduit. Un anneau élastique peut ensuite être placé à la racine du pénis pour maintenir l’érection. L’efficacité de ce dispositif dans le cadre de la DE post-PR a été démontrée pour la reprise de l’activité sexuelle (Baniel, Israilov et al. 2001). Il pourrait de plus avoir un effet protecteur sur le raccourcissement du pénis constaté par la plupart des patients après PR (Kohler, Pedro et al. 2007). Cependant, le taux d’abandon du traitement est élevé (>90% à un an) et la qualité des érections reste moyenne (pénis froid et bleuté en raison de l’érection « veineuse »).
Beaucoup équipes proposent ce traitement à titre systématique dans un but de rééducation sexuelle et d’oxygénation des tissus caverneux. Dans notre expérience, l’utilisation du vacuum présente un intérêt dans les fibroses péniennes étendues notamment secondaires aux IIC.
4) La mise en place d’implants péniens
La mise en place d’une prothèse pénienne peut être proposée en l’absence de récupération d’érections spontanées deux ans après une PR avec préservation nerveuse ou avant dans le cas contraire. Il s’agit du traitement de dernier recours car l’intervention nécessite le forage des corps caverneux pour y introduire des cylindres qui vont mimer une érection. Les prothèses actuelles sont gonflables et constituées de 3 pièces : deux cylindres intra-caverneux gonflables, un réservoir de sérum physiologique placé dans la cavité abdominale et une pompe intra-scrotale pour faire circuler le sérum physiologique entre les cylindres et le réservoir. Le patient peut ainsi mettre son pénis en état d’érection ou de flaccidité par une simple manipulation de la pompe.
L’ensemble du dispositif est implanté par une courte incision scrotale ou pré pubienne qui est à peine visible. Seule la pompe est palpable à travers la peau du scrotum.
De tous les traitement de la DE post PR, les implants péniens sont ceux qui donnent le plus fort taux de satisfaction des patients et de leur partenaires (Menard, Tremeaux et al. 2007).
Les complications sont devenues rares avec les implants de dernières générations (<2%). Il s’agit essentiellement d’infection du matériel et d’érosion ou de migration du matériel. Cette chirurgie doit être réservée aux centres spécialisés ayant une forte expérience dans ce domaine.

implants péniens TITAN (Coloplast)
Cette vidéo montre le fonctionnement d'une prothèse pénienne
VOIES DE RECHERCHE
Plusieurs stratégies thérapeutiques ont été étudiées pour prévenir ou favoriser la régénération des lésions nerveuses causées par la PR. Il s’agit essentiellement de l’injection de substances neuroprotectrices comme le FK506 (Burnett and Becker 2004) ou de facteurs de croissance nerveuse (Jung, Spencer et al. 1998), de la greffe de nerfs décellularisés (Connolly, Yoo et al. 2008) pour permettre d’orienter le processus de régénération axonale et de la greffe de cellules souches neuronales (Bochinski, Lin et al. 2004). Chez l’homme, des greffes de nerf sural ont été réalisées avec des résultats mitigés (Joffe and Klotz 2007).
D’autres approches thérapeutiques innovantes visant à remplacer les cellules péniennes endommagées après PR ont été envisagées. Des thérapies géniques (Bivalacqua, Deng et al. 2006) et cellulaires (Fall, Izikki et al. 2008) ont ainsi été testées dans des modèles animaux reproduisant une lésion des nerfs caverneux avec des résultats prometteurs. Les cellules souches issues de la moelle osseuse présentent l’intérêt de pouvoir remplacer les principales cellules péniennes altérées après PR. Il s’agit essentiellement des cellules conjonctives et musculaires lisses bordant les espaces sinusoïdes des corps caverneux et ces cellules vasculaires (Klein, Miller et al. 1997; User, Hairston et al. 2003; Fall, Izikki et al. 2009). Par ailleurs, les cellules souches médullaires ont un effet angiogénique et neurotrophique (Fall, Izikki et al. 2008). Les cellules médullaires mononuclées sont obtenues par ponction médullaire et gradient de Ficoll. Cette population cellulaire qui inclue les cellules souches mésenchymateuses et des cellules progenitrices endothéliales a été utilisée dans le cadre d’essais cliniques pour traiter l’insuffisance cardiaque ischémique (Perin, Dohmann et al. 2003; Ge, Li et al. 2006; Janssens, Dubois et al. 2006; Schachinger, Erbs et al. 2006) et l’ischémie aigue de membre (Tateishi-Yuyama, Matsubara et al. 2002).
Nous avons conduit le premier essai clinique thérapie cellulaire dans le cadre de la DE post-PR avec ce type de cellules (Yiou et al., Eur Urol, 2015: Safety of Intracavernous Bone Marrow-Mononuclear Cells for Postradical Prostatectomy Erectile Dysfunction: An Open Dose-Escalation Pilot Study). Nous avons montré chez 12 patients que l’injection de cellules souches médullaires n’entraine pas d’effet secondaire. L’analyse préliminaire suggère que cette thérapie pourrait améliorer la fonction érectile en augmentant la vascularisation pénienne. Ces résultats très prometteurs sont à confirmer par d’autres études.
CONCLUSIONS
La PR entraine une DE complexe multifactorielle et difficile à traiter. Les principaux traitements sont représentés par les iPDE5, les IIC et l’utilisation d’un vacuum. Leur association permet de réaliser une véritable rééducation sexuelle visant à limiter les dommages cellulaires péniens causés par la lésion des bandelettes vasculo-nerveuses. En cas d’échec prolongé, la mise en place d’implants péniens doit être proposée car cette intervention donne d’excellents résultats. Enfin des stratégies de thérapie cellulaire sont en cours d’évaluation dans cette indication.
A lire aussi
REFERENCES
Baniel, J., S. Israilov, et al. (2001). "Comparative evaluation of treatments for erectile dysfunction in patients with prostate cancer after radical retropubic prostatectomy." BJU Int 88(1): 58-62.
Behr-Roussel, D., A. Oudot, et al. (2008). "Daily treatment with sildenafil reverses endothelial dysfunction and oxidative stress in an animal model of insulin resistance." Eur Urol 53(6): 1272-1280.
Benoit, G., S. Droupy, et al. (1999). "Supra and infralevator neurovascular pathways to the penile corpora cavernosa." J Anat 195 ( Pt 4): 605-615.
Bivalacqua, T. J., W. Deng, et al. (2006). "Mesenchymal Stem Cells Alone or Ex Vivo Gene-Modified with Endothelial Nitric Oxide Synthase Reverse Age-Associated Erectile Dysfunction." Am J Physiol Heart Circ Physiol.
Bochinski, D., G. T. Lin, et al. (2004). "The effect of neural embryonic stem cell therapy in a rat model of cavernosal nerve injury." BJU Int 94(6): 904-909.
Brock, G., L. M. Tu, et al. (2001). "Return of spontaneous erection during long-term intracavernosal alprostadil (Caverject) treatment." Urology 57(3): 536-541.
Burnett, A. L., G. Aus, et al. (2007). "Erectile function outcome reporting after clinically localized prostate cancer treatment." J Urol 178(2): 597-601.
Burnett, A. L. and R. E. Becker (2004). "Immunophilin ligands promote penile neurogenesis and erection recovery after cavernous nerve injury." J Urol 171(1): 495-500.
Connolly, S. S., J. J. Yoo, et al. (2008). "Cavernous nerve regeneration using acellular nerve grafts." World J Urol 26(4): 333-339.
de la Taille, A., V. Delmas, et al. (1999). "Reasons of dropout from short- and long-term self-injection therapy for impotence." Eur Urol 35(4): 312-317.
Descazeaud, A., B. Debre, et al. (2006). "Age difference between patient and partner is a predictive factor of potency rate following radical prostatectomy." J Urol 176(6 Pt 1): 2594-2598; discussion 2598.
Droupy, S., A. Hessel, et al. (1999). "Assessment of the functional role of accessory pudendal arteries in erection by transrectal color Doppler ultrasound." J Urol 162(6): 1987-1991.
Fall, P. A., M. Izikki, et al. (2008). "Apoptosis and Effects of Intracavernous Bone Marrow Cell Injection in a Rat Model of Postprostatectomy Erectile Dysfunction." Eur Urol.
Fall, P. A., M. Izikki, et al. (2009). "Apoptosis and effects of intracavernous bone marrow cell injection in a rat model of postprostatectomy erectile dysfunction." Eur Urol 56(4): 716-725.
Ge, J., Y. Li, et al. (2006). "Efficacy of emergent transcatheter transplantation of stem cells for treatment of acute myocardial infarction (TCT-STAMI)." Heart 92(12): 1764-1767.
Glickman, L., G. Godoy, et al. (2009). "Changes in continence and erectile function between 2 and 4 years after radical prostatectomy." J Urol 181(2): 731-735.
Gontero, P., F. Fontana, et al. (2003). "Is there an optimal time for intracavernous prostaglandin E1 rehabilitation following nonnerve sparing radical prostatectomy? Results from a hemodynamic prospective study." J Urol 169(6): 2166-2169.
Gontero, P., M. Galzerano, et al. (2007). "New insights into the pathogenesis of penile shortening after radical prostatectomy and the role of postoperative sexual function." J Urol 178(2): 602-607.
Iacono, F., R. Giannella, et al. (2005). "Histological alterations in cavernous tissue after radical prostatectomy." J Urol 173(5): 1673-1676.
Janssens, S., C. Dubois, et al. (2006). "Autologous bone marrow-derived stem-cell transfer in patients with ST-segment elevation myocardial infarction: double-blind, randomised controlled trial." Lancet 367(9505): 113-121.
Joffe, R. and L. H. Klotz (2007). "Results of unilateral genitofemoral nerve grafts with contralateral nerve sparing during radical prostatectomy." Urology 69(6): 1161-1164.
Jung, G. W., E. M. Spencer, et al. (1998). "Growth hormone enhances regeneration of nitric oxide synthase-containing penile nerves after cavernous nerve neurotomy in rats." J Urol 160(5): 1899-1904.
Kim, S. C., S. W. Lee, et al. (1997). "Characteristics of pain following intracavernous injection of prostaglandin E1." J Korean Med Sci 12(4): 327-331.
Klein, L. T., M. I. Miller, et al. (1997). "Apoptosis in the rat penis after penile denervation." J Urol 158(2): 626-630.
Kohler, T. S., R. Pedro, et al. (2007). "A pilot study on the early use of the vacuum erection device after radical retropubic prostatectomy." BJU Int 100(4): 858-862.
Krane, R. J. (2000). "Urinary incontinence after treatment for localized prostate cancer." Mol Urol 4(3): 279-286;discussion 287.
Menard, J., J. C. Tremeaux, et al. (2007). "[Penile protheses multicentre practice evaluation, results after 282 procedures]." Prog Urol 17(2): 229-234.
Montorsi, F., A. Briganti, et al. (2004). "Current and future strategies for preventing and managing erectile dysfunction following radical prostatectomy." Eur Urol 45(2): 123-133.
Montorsi, F., G. Brock, et al. (2008). "Effect of nightly versus on-demand vardenafil on recovery of erectile function in men following bilateral nerve-sparing radical prostatectomy." Eur Urol 54(4): 924-931.
Montorsi, F., G. Guazzoni, et al. (1997). "Recovery of spontaneous erectile function after nerve-sparing radical retropubic prostatectomy with and without early intracavernous injections of alprostadil: results of a prospective, randomized trial." J Urol 158(4): 1408-1410.
Mulhall, J., S. Land, et al. (2005). "The use of an erectogenic pharmacotherapy regimen following radical prostatectomy improves recovery of spontaneous erectile function." J Sex Med 2(4): 532-540; discussion 540-532.
Mulhall, J. P. and R. J. Graydon (1996). "The hemodynamics of erectile dysfunction following nerve-sparing radical retropubic prostatectomy." Int J Impot Res 8(2): 91-94.
Mulhall, J. P., R. Slovick, et al. (2002). "Erectile dysfunction after radical prostatectomy: hemodynamic profiles and their correlation with the recovery of erectile function." J Urol 167(3): 1371-1375.
Perin, E. C., H. F. Dohmann, et al. (2003). "Transendocardial, autologous bone marrow cell transplantation for severe, chronic ischemic heart failure." Circulation 107(18): 2294-2302.
Podlasek, C. A., C. M. Gonzalez, et al. (2001). "Analysis of NOS isoform changes in a post radical prostatectomy model of erectile dysfunction." Int J Impot Res 13 Suppl 5: S1-15.
Rabbani, F., A. M. Stapleton, et al. (2000). "Factors predicting recovery of erections after radical prostatectomy." J Urol 164(6): 1929-1934.
Raina, R., G. Pahlajani, et al. (2007). "The early use of transurethral alprostadil after radical prostatectomy potentially facilitates an earlier return of erectile function and successful sexual activity." BJU Int 100(6): 1317-1321.
Salonia, A., A. Gallina, et al. (2008). "Acceptance of and discontinuation rate from erectile dysfunction oral treatment in patients following bilateral nerve-sparing radical prostatectomy." Eur Urol 53(3): 564-570.
Savoie, M., S. S. Kim, et al. (2003). "A prospective study measuring penile length in men treated with radical prostatectomy for prostate cancer." J Urol 169(4): 1462-1464.
Schachinger, V., S. Erbs, et al. (2006). "Intracoronary bone marrow-derived progenitor cells in acute myocardial infarction." N Engl J Med 355(12): 1210-1221.
Schramek, P., E. G. Plas, et al. (1994). "Intracavernous injection of prostaglandin E1 plus procaine in the treatment of erectile dysfunction." J Urol 152(4): 1108-1110.
Schwartz, E. J., P. Wong, et al. (2004). "Sildenafil preserves intracorporeal smooth muscle after radical retropubic prostatectomy." J Urol 171(2 Pt 1): 771-774.
Tateishi-Yuyama, E., H. Matsubara, et al. (2002). "Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial." Lancet 360(9331): 427-435.
Titta, M., I. M. Tavolini, et al. (2006). "Sexual counseling improved erectile rehabilitation after non-nerve-sparing radical retropubic prostatectomy or cystectomy--results of a randomized prospective study." J Sex Med 3(2): 267-273.
User, H. M., J. H. Hairston, et al. (2003). "Penile weight and cell subtype specific changes in a post-radical prostatectomy model of erectile dysfunction." J Urol 169(3): 1175-1179.
Walsh, P. C. and P. J. Donker (1982). "Impotence following radical prostatectomy: insight into etiology and prevention." J Urol 128(3): 492-497.
Weiss, J. N., G. H. Badlani, et al. (1994). "Reasons for high drop-out rate with self-injection therapy for impotence." Int J Impot Res 6(3): 171-174.
Zagaja, G. P., D. A. Mhoon, et al. (2000). "Sildenafil in the treatment of erectile dysfunction after radical prostatectomy." Urology 56(4): 631-634.