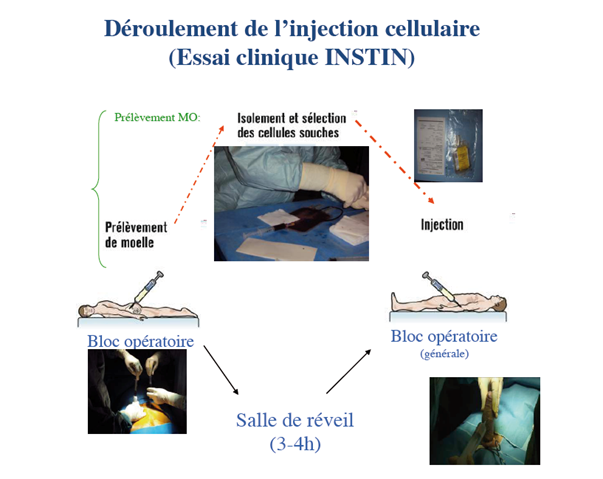
Essai clinique INSTIN (INtracavernous STem-cell INjection). INSERM-DHOS
Objectifs de l’essai clinique
L’objectif principal de cet essai clinique de phase I/II (NCT01089387) soutenu par l’INSERM et le Ministère de la Santé était de tester la faisabilité et la tolérance de l’injection de cellules souches médullaires dans le pénis pour le traitement de la dysfonction érectile après prostatectomie radicale. Les objectifs secondaires de l’étude étaient d’évaluer les effets de la greffe cellulaire sur la qualité des érections et les vaisseaux du pénis. Ce traitement n’ayant encore jamais été testé chez l’homme, il était nécessaire de faire un premier essai sur un petit nombre de patients en testant plusieurs doses de cellules.
L’essai clinique a été conduit sous la direction du Professeur René Yiou dans le service d’urologie du CHU Henri Mondor à Créteil.
Cadre général de l’essai clinique
Les troubles de l’érection (ou dysfonction érectile ou impuissance sexuelle) restent une séquelle fréquente après l’ablation chirurgicale de la prostate pour cancer (prostatectomie radicale) en dépit des développements technologiques robotiques récents (Ficarra, Novara et al. 2012). Ils sont susceptibles d’altérer sévèrement la qualité de vie et l’image de soi.
La dysfonction érectile est due à une lésion des nerfs et des vaisseaux du pénis qui sont normalement accolés aux faces latérales de la prostate avant d’atteindre les formations érectiles péniennes (corps caverneux). En raison de leurs rapports étroits avec la prostate, le sacrifice de ces pédicules vasculo-nerveux péniens est parfois nécessaire pour enlever en totalité une tumeur étendue. Des techniques chirurgicales de préservation ont été développées pour les tumeurs non agressives, cependant, même si la préservation des pédicules est tentée, le simple fait de les « détacher » de la prostate peut les léser de manière irréversible en raison de leur extrême fragilité (Ficarra, Novara et al. 2012). La dysfonction érectile qui s’en suit s’explique par une perte de cellules dans le pénis consécutive à la lésion -complète ou partielle- des pédicules vasculo-nerveux péniens. Lorsque ces lésions sont importantes et installées, elles peuvent être mises en évidence par une échographie doppler du pénis qui va constater une insuffisance d’apport sanguin artériel et/ou une fuite veineuse, c'est-à-dire une incapacité à maintenir le sang dans le pénis lors d’une tentative de déclenchement d’une érection. En pratique, le débit sanguin artériel peut être insuffisant pour gonfler le pénis (insuffisance artérielle) et/ou le sang arrivé dans le pénis repart aussitôt dans la circulation en raison d’une fuite veineuse, empêchant ainsi la rigidification du pénis. La constatation d’altérations vasculaires péniennes s’associe habituellement à une rétraction du pénis (Mulhall 2005) qui aggrave encore le traumatisme psychologique de la dysfonction érectile.
En raison de la complexité des lésions cellulaires péniennes qu’elle engendre, la prostatectomie radicale entraine une dysfonction érectile considérée comme l'une des plus difficiles à traiter. Le traitement de référence reste à ce jour l’injection intra-caverneuse de substances vasodilatatrices (prostaglandine E1, exemple : Edex ou Caverject) et/ou l’utilisation d’inhibiteurs de la phosophodiestérase de type V (ex : Viagra). Cependant, ces traitements sont peu efficaces en cas de fuite veineuse ou d’insuffisance artérielle et peuvent entraîner des douleurs importantes (injection d’Edex) empêchant tout rapport sexuel (Yiou, Cunin et al. 2011, Yiou, Butow et al. 2015). D’autres traitements sont disponibles comme la pompe à vide avec anneau pénien (vacuum) ou l’implantation chirurgicale d’une prothèse pénienne. Cependant ces traitements peuvent être perçus comme très contraignants et le taux d’abandon est élevé pour la plupart d’entre eux (de la Taille, Delmas et al. 1999, Salonia, Gallina et al. 2008).
Nous avons conduit un essai clinique pilote visant à réparer les lésions cellulaires péniennes causées par la prostatectomie radicale. Cette nouvelle approche thérapeutique a consisté à injecter dans le pénis des cellules dites souches prélevées dans la propre moelle osseuse des patients. De nombreuses études ont montré que la moelle osseuse contient plusieurs types de cellules souches ayant la capacité de se transformer spontanément en les mêmes types de cellules que celles endommagées dans le pénis après prostatectomie radicale (essentiellement les cellules endothéliales, musculaires lisses, conjonctives) et de secréter des facteurs spécifiques capables de réparer des vaisseaux sanguins et nerfs endommagés. L’injection de cellules souches médullaires a déjà été testée cliniquement dans d’autres maladies impliquant une insuffisance d’apport artériel comme l’infarctus du myocarde, l’ischémie de membre ou les accidents vasculaires cérébraux avec des résultats satisfaisants. Notre équipe a effectué des expériences chez l’animal et montré que l’injection dans le pénis de cellules souches de la moelle osseuse permettait de réparer des lésions cellulaires péniennes et ainsi de récupérer une fonction érectile quasi-normale (Fall, Izikki et al. 2009).
Méthodologie de l’essai
Dans cette étude, 12 patients consécutifs ont été inclus pour une durée totale de 6 mois (avec évaluation complémentaire à 12 mois). Tous les patients présentaient des troubles de l’érection sévères après une prostatectomie radicale, c’est à dire que le traitement médical maximal (Viagra+injection intracaverneuse de prostaglandines aux doses maximales et vacuum) restait inefficace après une durée moyenne de 22,9 mois. Cette dysfonction érectile réfractaire au traitement était associée à des troubles vasculaires sévères (insuffisance artérielle pénienne et/ou fuites veineuses) qui rendaient improbable le retour d’érections satisfaisantes. Habituellement, les patients présentant ces caractéristiques sont candidats à la mise en place définitive d’une prothèse pénienne car il est admis que seuls les patients réagissant au traitement médical ont une chance de récupérer des érections naturelles après prostatectomie radicale.
Quatre doses croissantes de cellules souches ont été testées car nous ne connaissions pas la quantité de cellules souches nécessaire pour un éventuel effet clinique (cette quantité ne pouvant être déterminée à partir des expériences animales). Chaque patient participant à l’essai clinique n’a reçu qu’une seule injection.
Dans un premier temps, une ponction cellulaire au niveau de la crête iliaque du bassin était réalisée sous anesthésie générale au bloc opératoire (figure). Les cellules prélevées étaient immédiatement transmises à l’unité de thérapie cellulaire de l’Etablissement Français du Sang (Dr Rouard, EFS) afin de préparer le produit thérapeutique fini. Le produit cellulaire de qualité clinique, contrôlé et validé par l’EFS, était administré sous légère anesthésie 3 à 5 heures plus tard, dans chaque corps caverneux à l’aide d’une aiguille introduite dans le pénis.
Les effets de la greffe cellulaire ont été évalués par des auto-questionnaires spécifiques (IIEF15 et EHS) déterminant des scores de satisfaction des rapports sexuels, fonctions érectiles et orgasmiques, désir sexuel, et la rigidité du pénis obtenue avec ou sans prise de médicament pour l’érection. Une étude de la vascularisation pénienne a été effectuée par echodoppler pénien avant et après la greffe de cellules. Nous avons par ailleurs évalué les modifications de la taille du pénis après greffe, puisque la rétraction pénienne est une séquelle fréquente de la prostatectomie radicale.
Principaux résultats
Aucune complication grave n’a été constatée. Une douleur passagère au point de ponction osseuse (en moyenne 2/10, 10 étant la douleur maximale imaginable) était le principal effet secondaire rapporté par les patients. Aucune douleur n’a été ressentie au niveau du pénis après l’injection. Une baisse du taux de globules rouges sans conséquences a été notée du fait du prélèvement médullaire pour les doses les plus élevées.
Six mois après la greffe cellulaire, les chercheurs ont noté une amélioration significative des principaux scores sexuels, notamment un gain moyen du score évaluant la fonction érectile de +10 points (17,4/30 à 6 mois versus 7,3/30 avant la greffe) sur une échelle allant de 0 à 30 (30 correspondant à la meilleure fonction érectile possible). Les autres scores significativement améliorés concernaient la satisfaction globale des rapports sexuels : 6,8/10 à 6 mois versus 3,9/10 avant la greffe (10 étant le score le plus favorable) ; la qualité de l’orgasme : 6,3/10 à 6 mois versus 3,5/10 avant la greffe ; la rigidité du pénis lors des rapports : 2,6/4 à 6 mois versus 1,3/4 avant la greffe (4 indiquant une rigidité maximale). Au moins deux patients ont décrit une réapparition d’érections normales comme avant la prostatectomie radicale sans prise de médicament. Une augmentation moyenne de 1 cm de la longueur du pénis a été constatée. Les bénéfices cliniques ont été plus marqués pour les doses élevées et étaient associés à une normalisation des mesures vasculaires artérielles péniennes par écho Doppler. L’amélioration des scores sexuels s’est maintenue 1 an après la greffe même si certains patients continuaient à utiliser un traitement lors des rapports.
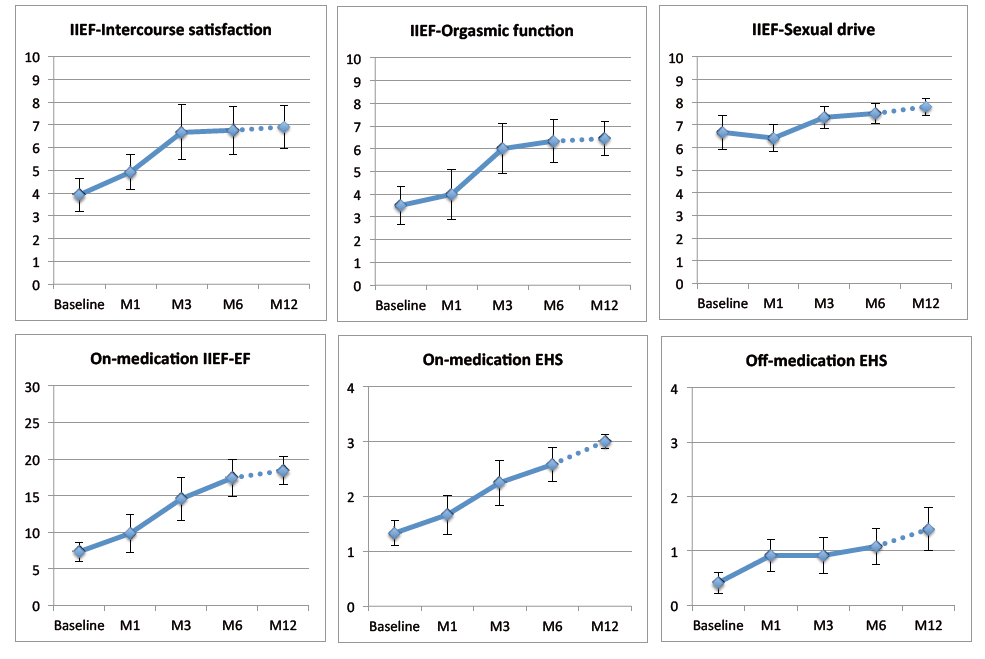
Evolution des scores sexuels 12 mois après la greffe de cellules souches médullaires. Légendes : IIEF : International Index of Erectile Function; EF (erectile function), fonction érectile; Intercourse satisfaction: satisfaction des rapports sexuels; Organsmic function: orgasme; Sexual drive: libido; EHS : Erection Hardness Score, score de rigidité pénienne.
Deux patients ont finalement choisi d’avoir une prothèse pénienne plus d’un an après la greffe cellulaire car ils jugeaient leur amélioration insuffisante. Ces patients avaient reçu les plus faibles doses de l’essai et il était impossible d’un point de vue réglementaire d’effectuer une 2e injection à plus forte dose.
Limites de l’étude et perspectives
Le faible nombre de patient inclus dans l’étude et l’absence de groupe contrôle qui aurait reçu une injection « placebo » ne permet pas avec certitude de démontrer l’efficacité de cette nouvelle stratégie thérapeutique. Cependant, il est important de comprendre que les patients traités présentaient tous une forme particulièrement sévère de dysfonction érectile ne répondant pas au traitement médical maximal. La probabilité d’amélioration spontanée des érections avait été jugée comme quasi-nulle par notre équipe. L’amélioration des scores sexuels associée à une normalisation des paramètres vasculaires péniens plaide en faveur d’un effet bénéfique de la greffe de cellules souches. Enfin, il semble important de signaler que la greffe cellulaire ne semble pas compromettre la pose d’une prothèse pénienne en cas de résultat insuffisant, et par conséquent ne ferme pas la porte à d’autres traitements.
Au total, cette stratégie thérapeutique pourrait constituer la première approche à visée curatrice de la dysfonction érectile après prostatectomie radicale. Si les résultats de notre étude sont confirmés par d’autres essais cliniques contrôlés, les indications de la thérapie cellulaire pourraient s’élargir aux autres formes de dysfonction érectile organique moins sévères ou résultant de maladies générales comme le diabète ou autres maladies vasculaires.
Ce travail a fait l’objet d’une publication dans la revue European Urology :
Yiou R, Hamidou L, Birebent B, Bitari D, Lecorvoisier P, Contremoulins I, Khodari M, Rodriguez AM, Augustin D, Roudot-Thoraval F, de la Taille A, Rouard H. Safety of Intracavernous Bone Marrow-Mononuclear Cells for Postradical Prostatectomy Erectile Dysfunction: An Open Dose-Escalation Pilot Study. Eur Urol. 2015 Oct 1. pii: S0302-2838(15)00934-3. doi: 10.1016/j.eururo.2015.09.026. [Epub ahead of print] PubMed PMID: 26439886.
A lire aussi
REFRENCES
de la Taille, A., V. Delmas, E. Amar and L. Boccon-Gibod (1999). "Reasons of dropout from short- and long-term self-injection therapy for impotence." Eur Urol 35(4): 312-317.
Fall, P. A., M. Izikki, L. Tu, S. Swieb, F. Giuliano, J. Bernabe, R. Souktani, C. Abbou, S. Adnot, S. Eddahibi and R. Yiou (2009). "Apoptosis and effects of intracavernous bone marrow cell injection in a rat model of postprostatectomy erectile dysfunction." Eur Urol 56(4): 716-725.
Ficarra, V., G. Novara, T. E. Ahlering, A. Costello, J. A. Eastham, M. Graefen, G. Guazzoni, M. Menon, A. Mottrie, V. R. Patel, H. Van der Poel, R. C. Rosen, A. K. Tewari, T. G. Wilson, F. Zattoni and F. Montorsi (2012). "Systematic review and meta-analysis of studies reporting potency rates after robot-assisted radical prostatectomy." Eur Urol 62(3): 418-430.
Mulhall, J. P. (2005). "Penile length changes after radical prostatectomy." BJU Int 96(4): 472-474.
Salonia, A., A. Gallina, G. Zanni, A. Briganti, F. Deho, A. Sacca, N. Suardi, L. Barbieri, G. Guazzoni, P. Rigatti and F. Montorsi (2008). "Acceptance of and discontinuation rate from erectile dysfunction oral treatment in patients following bilateral nerve-sparing radical prostatectomy." Eur Urol 53(3): 564-570.
Yiou, R., Z. Butow, J. Parisot, M. Binhas, O. Lingombet, D. Augustin, A. de la Taille and E. Audureau (2015). "Is it worth continuing sexual rehabilitation after radical prostatectomy with intracavernous injection of alprostadil for more than 1 year?" Sex Med 3(1): 42-48.
Yiou, R., P. Cunin, A. de la Taille, L. Salomon, M. Binhas, O. Lingombet, M. Paul and C. Abbou (2011). "Sexual rehabilitation and penile pain associated with intracavernous alprostadil after radical prostatectomy." J Sex Med 8(2): 575-582.