Développement de modèles anatomiques présentant un trouble de la statique pelvienne dans des espèces murines
Dans le but de développer de nouvelles stratégies thérapeutiques, il nous est apparu essentiel d’étudier des modèles animaux présentant un trouble de la statique pelvienne.
En 1999, notre attention s’est portée sur la souris transgénique UPA-/- chez qui il a été décrit de manière anecdotique des troubles de la statique pelvienne (Carmeliet, Schoonjans et al. 1994). Nous avons étudié les caractéristiques morphologiques des muscles du périnée de cette souris afin de déterminer l’origine de ces troubles et les applications possibles dans l’évaluation de thérapies cellulaires. Cette première étude nous a permis de comprendre l’organisation anatomique périnéale de la souris et les voies d’abord chirurgicales du sphincter strié urétral. Nous avons constaté que le trouble de la statique pelvienne correspondait en fait à un prolapsus des vésicules séminales entraînant une compression rectale. Il existait une importante différence de taille entre le sphincter mâle et femelle, le premier étant pour cette raison plus adapté à l’étude de la biologie de greffe cellulaire. L’étude histologique des muscles du périnée a mis en évidence des lésions de type myopathique étendues mais épargnant le sphincter strié urétral.
Ainsi, la souris UPA-/- n’est pas apparue comme un modèle d’incontinence urinaire spontanée en raison de l’absence d’atteinte du sphincter urétral ; cependant ce travail nous a permis d’identifier la souris mâle comme un modèle potentiel pour l’étude d’une lésion sphinctérienne en raison de la taille du sphincter urétral, et de préciser la nature des altérations histologiques musculaires périnéales présentes en cas de prolapsus pelvien- en pratique, souvent associé à l’incontinence urinaire. Ce travail préliminaire de description morphologique a fait l’objet d’une publication dans la revue Journal of Anatomy (Yiou, Delmas et al. 2001).
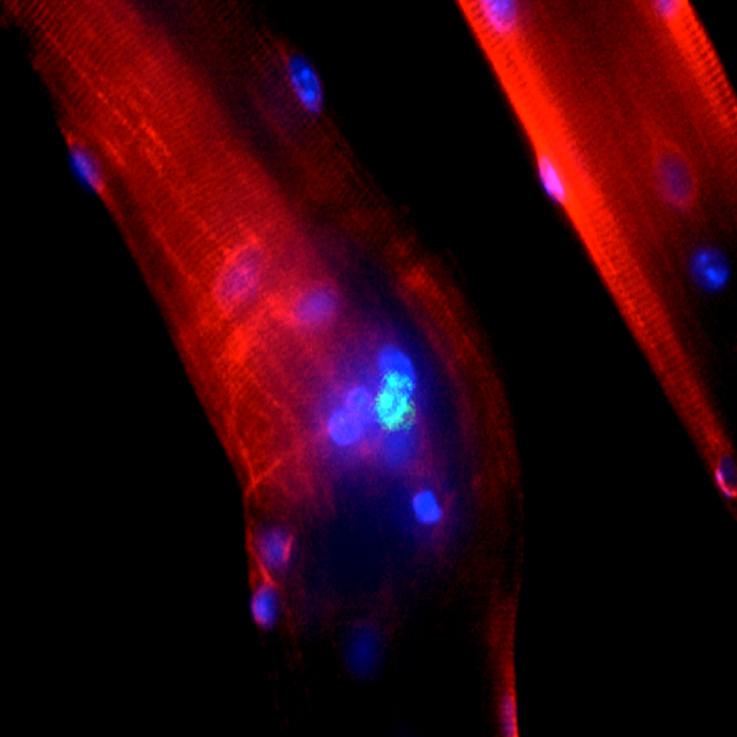
Nous avons ensuite cherché à induire une lésion sphinctérienne urétrale chez la souris mâle C57Bl6 par traumatisme physique puis par injection de notexine. Cette substance est connue pour entraîner une destruction des fibres musculaires striées en épargnant les cellules satellites. Nous avons constaté que l’injection intra-sphinctérienne de notexine entraîne une destruction brutale des fibres musculaires sphinctériennes suivie d’une activation de cellules satellites (exprimant Pax7+ puis MyoD+) et d’une régénération histologique du sphincter en 3 semaines. Pour cette étude nous avons développé une méthode d’évaluation de la contraction sphinctérienne ex vivo permettant de vérifier la récupération fonctionnelle 3 semaines après l’injection. Afin de mieux caractériser les cellules satellites sphinctériennes, une méthode de culture cellulaire sur fibres isolées (décrite plus loin) a été mise au point. Nous avons ainsi pu observer pour la première fois in vitro les cellules satellites sphinctériennes et confirmer leur capacité à se différencier en myotubes matures (alpha-actinine 2+) et contractiles.
Cette deuxième étude nous a permis de confirmer l’existence de cellules satellites dans le sphincter strié urétral. Les origines embryologiques particulières du sphincter urétral (non somitique chez le rat contrairement aux muscles striés squelettiques et leurs cellules satellites (Borirakchanyavat, Baskin et al. 1997)) posaient en effet la question de l’existence de telles cellules dans ce muscle à l’âge adulte et par conséquent de sa capacité à régénérer après une lésion.
Ce travail a donné lieu à une publication faisant la page de couverture de la revue Anatomy and Embryology (Yiou, Lefaucheur et al. 2003).
Les premiers essais de greffe cellulaire ont été réalisés à l’aide de ce modèle et ont permis de montrer que des CPM issues de muscles périphériques pouvaient s’intégrer au fibres musculaires sphinctériennes en cours de régénération après injection de notexine (Yiou, Dreyfus et al. 2002).
Cependant, ce modèle de lésion sphinctérienne nous est apparu insuffisant pour évaluer les effets à long terme d’une greffe de CPM dans la mesure où la régénération survenait de manière spontanée. Par ailleurs, la seule destruction des fibres musculaires n’est pas représentative des lésions histopathologiques rencontrées en cas d’ISU chez l’homme.
Nous avons donc cherché à développer un modèle de lésion sphinctérienne irréversible chez le rat mâle entraînant des modifications histopahtologiques durables. L’étude de la biologie de greffe de CPM d’un modèle d’ISU par éléctocoagulation a fait l’objet d’un séjour à l’université Harvard de Boston dans l’équipe du Dr. Atala.
Etude de la greffe intra sphinctérienne de CPM dans un modèle d’ISU par électrocoagulation
Chez la femme, l’ISU est le reflet d’une altération musculaire chronique complexe associant des lésions de dénervation chronique et une altération primaire des fibres musculaires avec fibrose (lésion de type myopathique) (Snooks, Barnes et al. 1985, Snooks, Swash et al. 1990, Prat-Pradal, Costa et al. 1991, Hale, Benson et al. 1999). Chez l’homme, l’ISU est souvent secondaire à une lésion directe des fibres musculaires sphinctériennes et de leur fibres nerveuses lors d’une chirurgie prostatique (Winters, Appell et al. 1998).
Le devenir de CPM injectées dans un contexte de dénervation chronique et de fibrose est mal connu. Afin d’étudier cet aspect de la biologie de greffe de CPM, nous avons mis au point chez le rat mâle un modèle de lésion sphinctérienne urétrale par électrocoagulation qui reproduit les certaines altérations histopathologiques à l’origine de l’ISU. En particulier, cette lésion provoque une destruction des fibres musculaires, des terminaisons nerveuses et des cellules satellites sphinctériennes. Après une phase inflammatoire, une fibrose irréversible avec atrophie se développe sans aucun signe de régénération (Yiou, Yoo et al. 2003).
Ce modèle lésionnel a été utilisé pour étudier les interactions entre les CPM injectées et le système nerveux urétral. Pour cela, nous avons testé des CPM autologues (cellules satellites) obtenues d’un muscle de la patte par la technique des fibres isolées. Les cellules satellites sont définies par leur position anatomique sous la membrane basale des fibres musculaires. Cette méthode consiste à isoler mécaniquement, après une courte phase de digestion enzymatique, des fibres musculaires entières avec leurs cellules satellites, puis à les placer en culture (Rosenblatt, Lunt et al. 1995). Durant le processus de dissociation musculaire, les cellules satellites restent théoriquement protégées de l’action des enzymes par la membrane basale des fibres. Après la mise en culture, les cellules satellites prolifèrent au contact des fibres puis s’en détachent ; elles peuvent ainsi être récoltées pour être injectées. L’absence de contact direct entre les cellules satellites et l’enzyme de digestion lors de la phase initiale de préparation limite le traumatisme cellulaire, ce qui pourrait être à l’origine d’une plus grande capacité proliférative in vitro (Yiou, Yoo et al. 2003).
Nous avons constaté que l’injection de CPM dans le sphincter lésé par électrocoagulation aboutissait à la formation de myotubes et à la récupération partielle des contractions lors de la stimulation électrique des pédicules nerveux urétraux. L’analyse histo-morphologique a montré, au site d’injection, une réapparition de terminaisons nerveuses dont certaines étaient connectées à un récepteur cholinergique sur les myotubes nouvellement formés. Ces résultats fonctionnels et morphologiques suggèrent que le processus myogénique induit par l’injection de CPM peut déclencher un bourgeonnement des terminaisons nerveuses sphinctériennes résiduelles. Ce travail a fait l’objet d’une publication dans la revue Transplantation (Yiou, Yoo et al. 2003).
Au total, ces travaux chez le rat nous ont apporté une justification originale à l’injection de CPM dans l’ISU en raison d’une action trophique potentielle sur le système nerveux urétral. Cette approche du problème est partagée par d’autres équipes travaillant sur ce sujet (Cannon, Lee et al. 2003, Kwon, Minnery et al. 2005).
Etude du devenir des CPM dans le sphincter strié en fonction de leur stade de maturation
L’une des principales problématiques de la greffe de CPM est la forte mortalité cellulaire après injection (Beauchamp, Morgan et al. 1999). Certains auteurs ont montré que seules les CPM ayant des caractéristiques de cellules souches ont la capacité de survivre et d’avoir une action thérapeutique dans le cadre de myopathies génétiques (Beauchamp, Morgan et al. 1999, Gussoni, Soneoka et al. 1999). À la fin des années 90, la recherche dans ce domaine s’est donc principalement orientée sur l’isolement et la caractérisation des cellules dites « souches» musculaires. Au cours des années 2000-2002, j’ai eu l’opportunité de travailler à la faculté Harvard Medical School avec l’équipe du Dr Gussoni qui a exploité une méthode d’extraction des cellules souches musculaires (cellules dites SP pour Side Population). J’ai donc pu tester le potentiel myogénique de ces cellules à l’aide du modèle d’insuffisance sphinctérienne précédemment décrit chez le rat ; l’objectif était d’optimiser le rendement de la greffe intra-sphinctérienne de CPM en sélectionnant celles ayant un fort potentiel myogénique.
Des CPM obtenues par la méthode des fibres isolées à partir d’un muscle de la patte ont été fractionnées par cytofluorimétrie selon la méthode décrite par Gussoni et al. (Gussoni, Soneoka et al. 1999) avant d’être injectées dans le sphincter préalablement détruit par électrocoagulation: les cellules ayant des caractéristiques de cellules souches (cellules SP, Side Population cells) ont été séparées du reste des CPM (cellules MP, Main Population). Nous avons constaté que les CPM de type SP survivent lorsqu’elles sont injectées seules, mais restent mononuclées et ne se différencient pas en myotubes. Inversement, les CPM matures (cellules MP) injectées après retrait des CPM de type SP ne survivent pas et n’ont aucun effet sur les contractions sphinctériennes. Enfin, lorsque les deux types de cellules sont réunis, on assiste à la formation de fibres musculaires innervées fonctionnelles.
La méthode utilisée pour obtenir ces cellules SP est originale car elle combine la technique hypersélective d’isolement des cellules satellites par fibres isolées et une cytofluorimétrie permettant de détecter la présence de cellules à caractéristique SP à partir d’une suspension cellulaire.
Les résultats de nos expériences ont montré en premier lieu qu’il existe des cellules SP parmi la population de cellules satellites (cette notion n’était pas connue alors). Nos résultats ont par ailleurs mis en évidence l’influence des facteurs environnementaux sur le potentiel myogénique des CPM. Ils suggèrent que, dans le contexte d’altération musculaire chronique sans régénération active qui caractérise l’ISU, l’injection d’une population hétérogène de CPM à différents stades de maturation est préférable à l’injection de cellules souches musculaires purifiées telle qu’elle était envisagée pour le traitement des myopathies génétiques. Ceci peut s’expliquer par le fait que dans un contexte de myopathie génétique (ex : maladie de Duchenne de Boulogne dont le modèle murin est la souris mdx), il existe des cycles répétés de dégénérescence/régénération musculaires avec une activation permanente des cellules satellites. Les cellules dystrophine+ injectées peuvent alors s’incorporer aux myotubes en cours de formation leur apportant ainsi le gène manquant. L’altération musculaire responsable de l’ISU est différente car plus stable et sans cycles de dégénérescence–régénération, par conséquent, il est probable que dans ce contexte, les facteurs environnementaux soient insuffisants pour induire la différenciation des cellules souches SP injectées seules vers une lignée myogénique.
A l’état basal, les cellules satellites des muscles striés ne sont pas toutes au même stade de maturation (Beauchamp, Heslop et al. 2000). Cette hétérogénéité se retrouve dans la population de cellules obtenues avec la technique des fibres isolées, et doit, à notre avis, être préservée pour la préparation des cellules en vue d’une injection pour le traitement de l’ISU. Dans notre étude, il est probable que les cellules les plus matures (MP), bien qu’ayant une survie limitée, aient participé à la différenciation des CPM immatures (SP) vers une lignée musculaire.
Bien que l’injection de CPM dans des conditions optimales (SP+MP) ait abouti à un résultat fonctionnel significatif (récupération de 41% de la fonction sphinctérienne normale), il est important de noter que le nombre de cellules utilisées était près de 500 fois supérieur au nombre de cellules satellites présentes à l’état basal dans un sphincter normal (estimation réalisée par comptage du nombre moyen de cellules satellites sur fibres isolées et du nombre de fibres musculaires dans le sphincter). Or, nous avons précédemment montré que les cellules satellites sphinctériennes propres peuvent après une injection de notexine (détruisant toutes les fibres mais épargnant les cellules satellites) reconstituer l’ensemble des fibres détruites en 3 semaines (Yiou, Lefaucheur et al. 2003). Ces expériences indiquent que le processus de préparation des cellules satellites peut altérer leur potentiel myogénique.
Les résultats de greffe de CPM de type SP ont fait l’objet d’une publication dans la revue Transplantation (Yiou, Yoo et al. 2005).
A lire aussi
REFRENCES
Beauchamp, J. R., L. Heslop, D. S. Yu, S. Tajbakhsh, R. G. Kelly, A. Wernig, M. E. Buckingham, T. A. Partridge and P. S. Zammit (2000). "Expression of CD34 and Myf5 defines the majority of quiescent adult skeletal muscle satellite cells." J Cell Biol 151(6): 1221-1234.
Beauchamp, J. R., J. E. Morgan, C. N. Pagel and T. A. Partridge (1999). "Dynamics of myoblast transplantation reveal a discrete minority of precursors with stem cell-like properties as the myogenic source." J Cell Biol 144(6): 1113-1122.
Borirakchanyavat, S., L. S. Baskin, B. A. Kogan and G. R. Cunha (1997). "Smooth and striated muscle development in the intrinsic urethral sphincter." J Urol 158(3 Pt 2): 1119-1122.
Cannon, T. W., J. Y. Lee, G. Somogyi, R. Pruchnic, C. P. Smith, J. Huard and M. B. Chancellor (2003). "Improved sphincter contractility after allogenic muscle-derived progenitor cell injection into the denervated rat urethra." Urology 62(5): 958-963.
Carmeliet, P., L. Schoonjans, L. Kieckens, B. Ream, J. Degen, R. Bronson, R. De Vos, J. J. van den Oord, D. Collen and R. C. Mulligan (1994). "Physiological consequences of loss of plasminogen activator gene function in mice." Nature 368(6470): 419-424.
Gussoni, E., Y. Soneoka, C. D. Strickland, E. A. Buzney, M. K. Khan, A. F. Flint, L. M. Kunkel and R. C. Mulligan (1999). "Dystrophin expression in the mdx mouse restored by stem cell transplantation." Nature 401(6751): 390-394.
Hale, D. S., J. T. Benson, L. Brubaker, M. C. Heidkamp and B. Russell (1999). "Histologic analysis of needle biopsy of urethral sphincter from women with normal and stress incontinence with comparison of electromyographic findings." Am J Obstet Gynecol 180(2 Pt 1): 342-348.
Kwon, D., B. Minnery, Y. Kim, J. H. Kim, F. de Miguel, N. Yoshimura and M. B. Chancellor (2005). "Neurologic recovery and improved detrusor contractility using muscle-derived cells in rat model of unilateral pelvic nerve transection." Urology 65(6): 1249-1253.
Prat-Pradal, D., P. Costa, S. Lopez, P. Mares, J. Bossy, J. Pelissier and H. Navratil (1991). "[Female urinary stress incontinence and insufficient closing pressures. Results of perineal sphincter electromyography]." Prog Urol 1(4): 546-553.
Rosenblatt, J. D., A. I. Lunt, D. J. Parry and T. A. Partridge (1995). "Culturing satellite cells from living single muscle fiber explants." In Vitro Cell Dev Biol Anim 31(10): 773-779.
Snooks, S. J., P. R. Barnes, M. Swash and M. M. Henry (1985). "Damage to the innervation of the pelvic floor musculature in chronic constipation." Gastroenterology 89(5): 977-981.
Snooks, S. J., M. Swash, S. E. Mathers and M. M. Henry (1990). "Effect of vaginal delivery on the pelvic floor: a 5-year follow-up." Br J Surg 77(12): 1358-1360.
Winters, J. C., R. A. Appell and R. R. Rackley (1998). "Urodynamic findings in postprostatectomy incontinence." Neurourol Urodyn 17(5): 493-498.
Yiou, R., V. Delmas, P. Carmeliet, R. K. Gherardi, G. Barlovatz-Meimon, D. K. Chopin, C. C. Abbou and J. P. Lefaucheur (2001). "The pathophysiology of pelvic floor disorders: evidence from a histomorphologic study of the perineum and a mouse model of rectal prolapse." J Anat 199(Pt 5): 599-607.
Yiou, R., P. Dreyfus, D. K. Chopin, C. C. Abbou and J. P. Lefaucheur (2002). "Muscle precursor cell autografting in a murine model of urethral sphincter injury." BJU Int 89(3): 298-302.
Yiou, R., J. P. Lefaucheur and A. Atala (2003). "The regeneration process of the striated urethral sphincter involves activation of intrinsic satellite cells." Anat Embryol (Berl) 206(6): 429-435.
Yiou, R., J. J. Yoo and A. Atala (2003). "Restoration of functional motor units in a rat model of sphincter injury by muscle precursor cell autografts." Transplantation 76(7): 1053-1060.
Yiou, R., J. J. Yoo and A. Atala (2005). "Failure of differentiation into mature myotubes by muscle precursor cells with the side-population phenotype after injection into irreversibly damaged striated urethral sphincter." Transplantation 80(1): 131-133.