La mise au point d’un modèle anatomique d’incontinence urinaire avec une méthode d’évaluation de l’activité tonique urétrale nous a permis d’étudier la biologie de greffe intra-urétrale de CPM dans des conditions pré-cliniques. Plusieurs méthodes de marquage cellulaire et de transfert cellulaire ont été testées. Ces travaux ont été réalisés par le Dr Lecoeur (Master 2) et le Dr Laurent Zini (Master 2 et Thèse d’Université).
Protocole expérimental
Dans un premier temps, nous avons cherché à obtenir des CPM selon la méthode des fibres isolées utilisée précédemment chez le rat. Cependant, cette méthode s’est avérée irréalisable avec du muscle de truie en raison de la taille importante des fibres. Nous avons donc opté pour une technique classique d’obtention de CPM. Celles-ci ont été obtenues à partir d’une biopsie musculaire (10 g de muscle sterno-cléido-mastoïdien) après des étapes successives d’éminçage, de digestion enzymatique (collagénase de type I) et de culture cellulaire en incubateur à 37°C (une semaine). Ces techniques de culture de CPM de truie ont été mises au point par le Dr Zini.
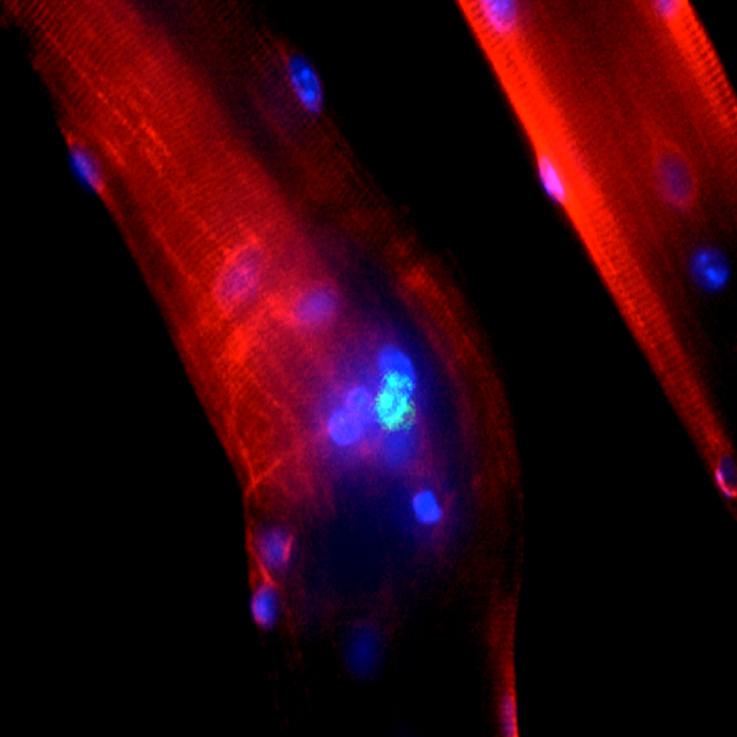
Environ 108 cellules dont 60% exprimaient la desmine, un marqueur de cellules satellites activées (Li, Lilienbaum et al. 1989), ont été injectées dans le sphincter préalablement détruit par électrocoagulation de 6 truies. Pour chaque injection cellulaire intra sphinctérienne, un échantillon de cellules était conservé pour vérifier la présence de cellules myogéniques (marquage anti-desmine) et leur différenciation spontanée de myotubes en culture (voir figure 4).
Les animaux ont eu un bilan urodynamique un mois après la greffe puis ont été sacrifiés. Les urètres ont été prélevés pour analyse histologique.
Technique de marquage cellulaire
Plusieurs techniques de marquage cellulaire ont été testées préalablement pour étudier le devenir des CPM injectées dans l’urètre.
Nous avons successivement testé le marquage membranaire PKH26 puis un adénovirus GFP et enfin un marquage par nanoparticules ferriques permettant une détection histologique (coloration de Perl’s) et IRM. C’est principalement cette dernière technique qui a été utilisée dans les expériences de greffe cellulaire. Le marquage par nanoparticules ferriques des CPM en culture et par la suite des fibres musculaires avec leurs cellules satellites a fait l’objet du DEA du Dr Lecoeur en collaboration avec le Dr Rivière (Laboratoire Matière et Systèmes Complexes, UMR CNRS 7057, Université Paris-Diderot) et d’une publication dans la revue Biomaterials (Rivière et al, Biomaterials, 2009).
Résultats et conclusions des expériences préliminaires
Les injections de CPM cultivées et marquées avec nanoparticules chez la truie n’ont pas modifié les résultats des bilans urodynamiques. Les nanoparticules ferriques pouvaient être mises en évidence par la coloration de Perl’s sur coupe histologique (couleur bleue) et par IRM. Cependant, nous n’avons pas noté de formation de myotubes ni la persistance de cellules myogéniques sur les coupes d’urètre à l’endroit où les nanoparticules ferriques étaient détectées.
Nous avons conclu à l’échec de l’injection de CPM obtenues et cultivées selon une méthode conventionnelle pour la réparation d’un sphincter strié urétral lésé.
Nous avons interprété ce résultat par la mort rapide des cellules après injection.
Simultanément à l’obtention de ces résultats, d’autres équipes de recherche ont publié des résultats d’expériences mettant en cause différentes étapes de la préparation des CPM dans la surmortalité cellulaire après injection. En particulier, l’étape de digestion enzymatique utilisée pour libérer les CPM du fragment musculaire a été identifiée comme une cause possible de fragilisation cellulaire à l’origine d’une perte de myogénicité. Par exemple, Collins et al. ont montré que l’implantation d’une seule fibre musculaire avec ses 7 cellules satellites dans un muscle détruit de souris aboutit à la formation de plus d’une centaine de nouvelles fibres musculaires à condition que les cellules satellites n’aient pas été en contact avec une enzyme d’extraction (Collins, Olsen et al. 2005). Ces auteurs ont poursuivi leur étude en montrant que si les cellules satellites étaient séparées de leur fibre parentale par digestion enzymatique, leur potentiel myogénique diminuait de manière considérable, nécessitant l’utilisation de plusieurs milliers de cellules pour obtenir le même effet.
La même année, l’équipe de Montarras et al. a remis en question l’utilité d’une phase d’expansion cellulaire avant l’injection (Montarras, Morgan et al. 2005) en montrant que cette étape n’augmente pas le rendement de la greffe en raison de l’altération du potentiel myogénique qui en découle.
Ainsi, à la suite des résultats préliminaires chez la truie et d’une analyse de la littérature, nous sommes orientés vers une nouvelle stratégie de greffe intra-sphinctérienne consistant à implanter directement des fibres musculaires avec leurs cellules satellites sans phase d’extraction cellulaire ni culture afin de limiter l’altération du potentiel myogénique.
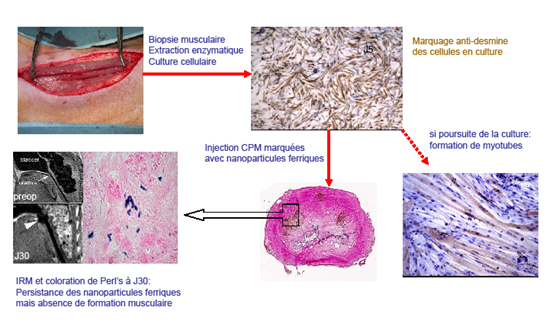
Figure 4 : injection de CPM cultivées et marquées par nanoparticules ferriques dans le sphincter de la truie. On note une persistance des nano particules dans l’urètre (détectables par IRM et coloration histologique de Perl’s) mais une absence de formation de myotubes au site d’injection alors que si les CPM sont cultivées plus de 10 jours, une formation spontanée de myotubes se produit.
A lire aussi