Injection Péri-Sphinctérienne de Myofibres Autologues (IPSMA) pour le traitement de l’incontinence urinaire par insuffisance sphinctérienne : un essai clinique de phase II- PHRC Régional- CHU Henri Mondor
Vous pouvez télécharger la lettre d’information sur cet essai clinique en cliquant ici.
 Justification scientifique
Justification scientifique
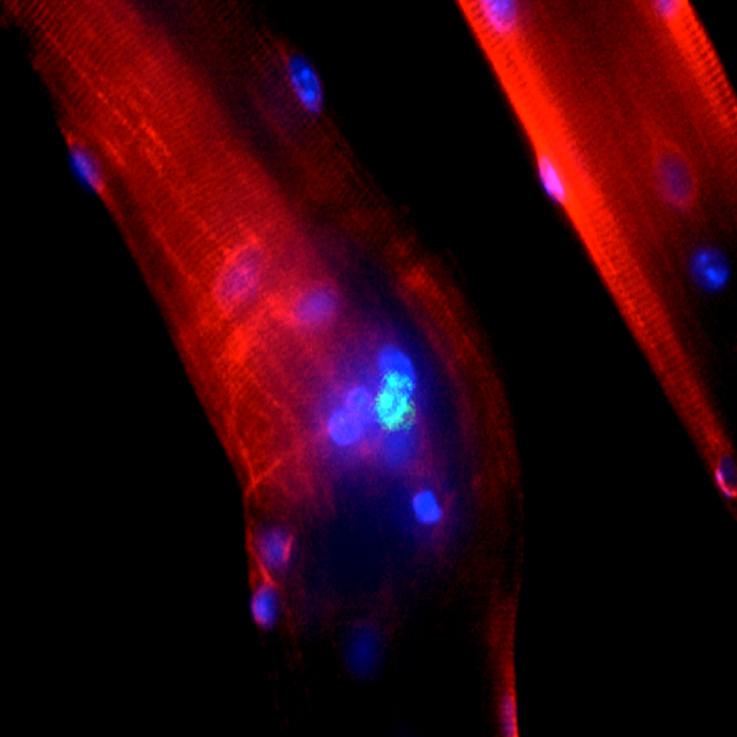
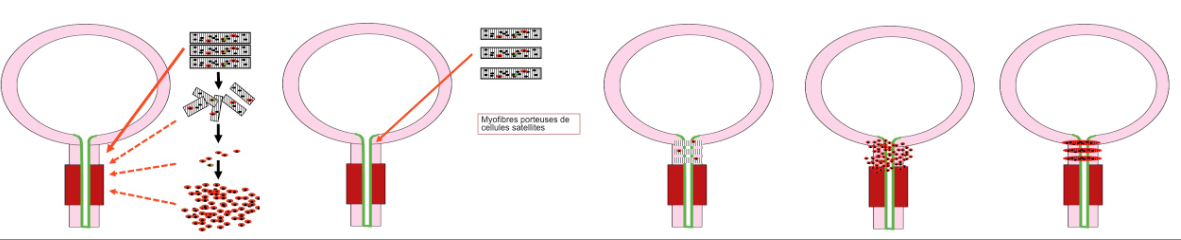
L’incontinence urinaire d’effort (IUE) par insuffisance sphinctérienne urétrale (ISU) peut être à l’origine d’un handicap sévère. Les principaux traitements sont chirurgicaux et consistent en l’implantation de dispositifs médicaux susceptibles d’endommager l’urètre à long terme. Nous avons développé une nouvelle stratégie thérapeutique pour l’ISU consistant à implanter des myofibres avec leurs cellules satellites (principales cellules souches du muscle) non cultivées à proximité du sphincter strié urétral. Le principe de cette méthode repose sur l’activation in vivo des cellules satellites conduisant à la formation de myotubes générant une activité musculaire propre. La preuve du concept a été apportée précédemment par un essai clinique de phase I: les résultats ont montré une amélioration significative de la continence et de l’activité électomyographique péri-urétrale après implantation de myofibres chez des femmes présentant une ISU sévère (Yiou et al., BJUint, 2013). La technique précédemment testée reste invasive car elle nécessite un abord chirurgical de l’urètre. Pour l’essai clinique proposé, nous avons cherché à optimiser le processus de greffe cellulaire péri-sphinctérienne chez la femme en mettant au point une méthode d’isolement des myofibres par hydro-dissection et une technique d’injection par voie percutanée sous contrôle radioscopique et endoscopique (procédure IPSMA). Cette technique pourrait permettre de réaliser des injections itératives en cas d’effet incomplet.
Cet article décrit les objectifs et les hypothèses testées de cet essai clinique ainsi que les méthodes d'évaluation.
Hypothèse
L’Injection Péri-Sphinctérienne de Myofibres Autologues (IPSMA) améliore la continence et les paramètres urodynamiques-EMG d’évaluation de la fonction sphinctérienne en cas d’ISU chez la femme
Objectif et critère d’évaluation principal
Evaluer l’efficacité de la procédure IPSMA dans le traitement de l’ISU chez la femme.
Critère d’évaluation principal : Proportion de patientes répondeuses à 1 an.
Définition de la réponse au traitement :
- diminution du pad-test (évaluation des pertes urinaires par pesée des protections urinaires) de 24h > 50%
- diminution du nombre de fuites quotidiennes > 50%.
Objectifs et critères d’évaluation secondaires
- Objectif(s) secondaire(s) : Evaluer l’innocuité de la procédure IPSMA, le délai de réponse et de guérison et l’amélioration des paramètres urodynamiques et électromyographiques. Evaluation des coûts de l’intervention et de l’ensemble de la stratégie.
- Critère(s) d’évaluation secondaire(s) : 1) survenue d’événements indésirables (infection, rétention urinaire) dépistés par ECBU et échographie périnéale et d’événement indésirables graves; 2) guérison complète définie par une absence de protection urinaire et une absence de fuites reportées sur le catalogue mictionnel à un an ; 3) amélioration des scores de qualité de vie et d’évaluation des symptômes urinaires; 4) délai de réponse ; 5) critères d’évaluation urodynamiques - (Leak point pressure LPP et pression de clôture urétrale PCU)- et EMG ; 6) coûts de l’intervention et de l’ensemble de la stratégie
Schéma expérimental, Méthodologie :
Essai clinique de phase IIa, prospectif, ouvert, non randomisé, non contrôlé, monocentrique pour la première tape et multicentrique pour la deuxième étape. Evaluations avant l’IPSMA puis à 1, 3, 6 et 12 mois post-opératoires par auto-questionnaires validés, pad-tests, bilan urodynamique-EMG (pré-opératoire, M3 et M12) en insu de l’opérateur.
Nombre de sujets nécessaires : L’évaluation de l’efficacité et de la tolérance sera réalisée selon un plan de Simon. Pour l’évaluation du critère de jugement principal, les 2 risques consentis (α et β) sont de 10 % et les seuils retenus 60 % et 80 %. La 1ère phase inclura 11 femmes et en cas de succès l’étude se poursuivra jusqu’à 38 femmes. En admettant 10% de perdus de vue ou de critère de jugement non évaluable (n=4), 42 patients sont à inclure.
Population concernée
Patientes ayant une incontinence urinaire d’effort (IUE) par insuffisance sphinctérienne urétrale (ISU) depuis au moins 6 mois, ne réagissant pas à la rééducation pelvi-périnéale
Critères d’inclusion Sexe féminin, ISU : Pad test>50g/24h, LPP<100 cmH20, PCU<50 cmH2O. Urètre fixé (Manœuvre de soutènement urétral négative et QTip test<30°).
Principaux critères de non inclusion
Autres formes d’incontinence urinaire que l’ISU. Incontinence avec hypermobilité vésico-urétrale corrigée par manœuvre de soutènement urétrale.
Traitements de référence
En fonction des centres : Sphincter urinaire artificiel, ballons compressifs ACT, injection de substances de comblement.
Autres actes ajoutés par la recherche
• La procédure chirurgicale IPSMA est spécifique à la recherche.
• Les bilans urodynamiques/EMG post-opératoires.
• L’urétrocystoscopie et l’échographie périnéale (réalisée en consultation) habituellement non réalisés après un traitement de l’incontinence urinaire sauf en cas d’échec.
Risques ajoutés par la recherche : C
Déroulement pratique
Nous proposerons aux patientes adressées en consultation pour une IUE par ISU de participer à l’essai clinique.
Nombre de sujets nécessaires
L’évaluation de l’efficacité et de la tolérance sera réalisée selon un plan de Simon. Pour l’évaluation du critère de jugement principal, les 2 risques consentis (α et β) sont de 10 % et les seuils retenus 60 % et 80 %. La 1ère phase inclura 11 femmes et en cas de succès l’étude se poursuivra jusqu’à 38 femmes. En admettant 10% de perdus de vue ou de critère de jugement non évaluable (n=4), 42 patientes sont à inclure.
Nombre de centres
Première phase
2 centres de sélection des patientes (CHIC + CHU Mondor)) et 1 centre d’intervention chirurgicale (CHU Mondor)
Deuxième phase : après transfert de compétences
3 centres (CHU Mondor/ CHI Créteil / CHI Poissy)
Durée de la recherche
- durée d’inclusion : 23 mois
- durée de participation par patiente(traitement + suivi) : 13 mois
- durée totale 36 mois
Analyse statistique
L’analyse des résultats sera réalisée en intention de traiter.
La proportion de réponse à 12 mois sera présentée sous forme de pourcentage et intervalle de confiance à 95 % selon une distribution binomiale.
Comité de Surveillance Indépendant prévu Oui
Impact potentiel des résultats attendus sur la prise en charge des patients
L’implantation de myofibres pourrait constituer une nouvelle stratégie thérapeutique dans le traitement de l’ISU visant à rétablir une fonction sphinctérienne physiologique. Actuellement, il n’existe pas de traitement ayant pour objectif de réparer les lésions cellulaires à l’origine de cette pathologique invalidante. Les principaux traitements de l’ISU font appel à la mise en place de dispositifs médicaux compressifs sur l’urètre et parfois responsables de complications locales (érosions urétrales, infections). Par ailleurs, le bénéfice apporté par ces interventions peut être insuffisant notamment en cas d’ISU sévère.
La technique de greffe cellulaire proposée est simple et ne requiert pas de laboratoire de culture cellulaire ni de matériel spécifique. Il n’y aura pas de modification cellulaire avant injection. Elle pourrait donc être facilement diffusable si l’effet bénéfique est démontré. Par ailleurs, l’implantation de myofibres pourrait trouver une indication en tant que thérapie adjuvante en cas d’effet incomplet d’un précédant traitement.
La greffe de myofibres pourrait dans un second temps être proposée en cas d’ISU chez l’homme notamment après prostatectomie radicale.
Acronyme IPSMA
Investigateur coordonnateur : Professeur René Yiou - CHU Henri Mondor
Promoteur : Assistance Publique – Hôpitaux de Paris
Ouverture de l’essai clinique : Février 2016
CONTACT
Professeur René Yiou
Service d'Urologie
CHU Henri Mondor
51, av. du Mal de Lattre de Tassigny
94010 Créteil, France
Secrétariat: +33 (0)1.49.81.25.59
Email : Cette adresse e-mail est protégée contre les robots spammeurs. Vous devez activer le JavaScript pour la visualiser.
A lire aussi