Problématique de la greffe de CPM (cellules précurseurs musculaires) dans le cadre de l’incontinence urinaire : une greffe de CPM peut elle améliorer le tonus musculaire urétral ?
L’étude de la biologique de greffe intrasphinctérienne de CPM nécessite de prendre en compte les caractéristiques morphologiques et fonctionnelles du sphincter strié et les bases anatomiques de la continence urinaire.
Le système de clôture urétral qui garantit la continence urinaire est la résultante de l’activité musculaire du sphincter strié et des cellules musculaires lisses urétrales et de la trophicité de la muqueuse urétrale (Haab, Zimmern et al. 1996). Le sphincter strié de l’homme est un muscle composé de fibres de type I, à métabolisme aérobique, ayant comme principale caractéristique de développer des contractions prolongées (toniques) (Gosling, Dixon et al. 1981; Hale, Benson et al. 1999). Il s’agit d’un muscle original puisqu’il est contracté inconsciemment et en quasi permanence. Ce mode de fonctionnement le différencie des muscles de type II rapidement fatigables et dont les contractions se font sous commande volontaire. La diminution de l’action tonique du sphincter en cas d’ISU est mise en évidence par une diminution de la pression intra-urétrale au cours d’un bilan urodynamique (pression de clôture).
La finalité de la thérapie cellulaire de l’ISU est donc d’obtenir une augmentation constante de la pression intra-urétrale avec préservation de la fonction de relâchement lors de la miction. Les données actuelles de la littérature sur les thérapies cellulaires ne permettent pas de présager un tel effet. Jusqu’à présent, l’évaluation de l’activité tonique sphinctérienne et de son contrôle nerveux n’a pu être effectuée chez la souris ou le rat. Nous avons montré par une étude morphologique que le sphincter urétral de ces espèces est essentiellement composé de fibres de type II (Yiou, Delmas et al. 2001) ne développant pas une activité tonique suffisante pour être quantifiée. C’est la raison pour laquelle nous avons cherché à développer un modèle d’ISU chez un animal dont le sphincter urétral présentait des caractéristiques morphologiques proches de celui de l’homme. Nous avons étudié l’anatomie de l’appareil sphinctérien urinaire de la truie et montré qu’il répond aux exigences anatomiques et fonctionnelles requises pour évaluer l’effet d’une greffe de CPM sur la tonicité urétrale. Les paragraphes suivants exposent les résultats obtenus chez cet animal.
Caractérisation de la fonction sphinctérienne urétrale chez la truie. Etude morphologique comparative homme/truie (figures 1-3).
Nous avons étudié l’appareil sphinctérien de la truie afin de mettre en évidence des similitudes morphologiques et fonctionnelles avec le sphincter de l’homme. Dans les deux espèces, le sphincter strié présente une forme en Oméga et une forte composition en fibres musculaires toniques de type I, capables d’exercer des contractions prolongées.
Le rôle joué par le sphincter strié urétral dans le tonus sphinctérien a été évalué par une méthode originale consistant à mesurer la pression intra urétrale avant et après injection intraveineuse de curare pour bloquer les jonctions neuro-musculaires du sphincter strié. La curarisation entraîne une baisse de pression intra urétrale qui reflète exclusivement la pression exercée par le sphincter strié car n’ayant pas d’effet sur les contractions du muscle lisse urétral. Il s’agit à notre connaissance de la première méthode de quantification des contractions sphinctériennes striée.
Mise au point d’un modèle de lésion sphinctérienne urétrale chez la truie
Par la suite, un modèle de lésion sphinctérienne par électrocoagulation endoscopique a été mis au point chez cet animal en prenant exemple sur le modèle développé chez le rat. La destruction endoscopique élective du sphincter strié entraîne une baisse de la pression intra urétrale qui est identique à celle que l’on observe après curarisation, à ceci près qu’elle est définitive (c.f. figures 1-3). Ce travail fait l’objet d’une publication dans la revue Journal of Urology (Zini, Lecoeur et al. 2006).
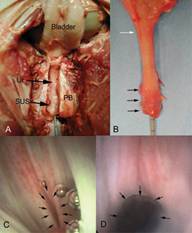
FIGURE 1. Etude anatomique et endoscopique du sphincter strié urétral chez la truie
A: la symphyse pubienne (PB) a été sectionnée pour mettre en évidence l’urètre (Ur). Le sphincter strié urétral (SUS) entoure le tiers distal de l’urètre et se situe en arrière du bord inférieur du pubis.
B: le SUS (flèches noires) est clairement mis en évidence après ablation en bloc de la vessie et de l’urètre. Il est situé à distance du col vésical (flèches blanches). Un cathéter a été introduit dans l’urètre (distance entre 2 marques: 1 cm).
C: aspect endoscopique de l’urètre. Il existe un rétrécissement (flèches noires) de la lumière urétrale en regard du tiers distal de l’urètre où se trouve le SUS.
D: un mois après lésion du SUS par voie endoscopique, on note un urètre qui reste béant (flèches noires).
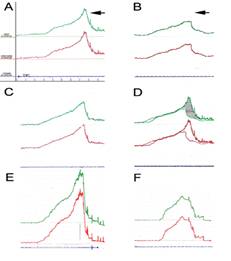 FIGURE 2. Etude urodynamique
FIGURE 2. Etude urodynamique
Aspect de la profilométrie urétrale avant (A) et après injection IV de curare (B, C) réalisée chez un animal anesthésié. Les pressions urétrales (rouge) et vésicales (bleu) sont mesurées simultanément pour déterminer la pression de clôture urétrale (vert) définie par PC = Purétrale – Pvésicale. Les pressions sont mesurées progressivement en retirant le capteur depuis la vessie jusqu’à l’extérieur.
Avant curarisation, un pic de pression est noté (A, flèche) dans la partie distale de l’urètre qui est entourée par le sphincter strié urétral. Ce pic de pression est aboli 15 min après injection de curare (B, flèche)
C: une heure après injection de curare (délai d’élimination du curare) la profilométrie retrouve un aspect normal.
D: superposition des figures A et B. La surface hachurée montre la force de contraction tonique sphinctérienne.
E: profilométrie urétrale avant lésion sphinctérienne.
F: aspect de la profilométrie du même animal un mois après destruction endoscopique du 1/3 distal de l’urètre où se trouve le sphincter strié. La modification observée est similaire à ce que l’on observe 15 min après injection de curare chez un animal sain (disparition du pic de pression distale). Les expériences de curarisation et de destruction sélective du sphincter démontrent et quantifient le rôle joué par le sphincter strié urétral dans le tonus basal urétral.
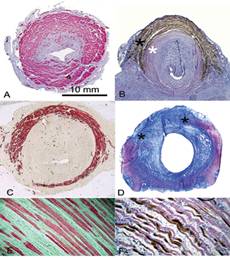 FIGURE 3. Etude histologique comparée du sphincter strié de l’homme et de la truie
FIGURE 3. Etude histologique comparée du sphincter strié de l’homme et de la truie
A, B: double immuno-marquage des cellules musculaires lisses (α-smooth muscle actin, Fast Red, rouge) et des fibres musculaires de type I (Myosin Heavy Chain slow, DAB, marron) dans le tiers proximal (A) et le tiers distal de l’urètre (B) de truie. La couche musculaire du tiers proximal de l’urètre est composée exclusivement de cellules musculaires lisses (A). Les fibres musculaires du sphincter strié sont présentes autour du tiers distal de l’urètre (B, astérisque noir) et entourent une fine couche de cellules musculaires lisses (astérisque blanc).
C: coupe de sphincter strié humain (Myosin Heavy Chain slow, Fast Red).
D: aspect du sphincter strié urétral un mois après destruction de sa partie ventrale (Trichrome de Masson). L’électrocoagulation entraînait une disparition des fibres sphinctériennes et une fibrose. La partie lésée du sphincter est située entre les deux astérisques.
E, F: double immunomarquage des fibres de type I (Myosin Heavy Chain slow, Fast Red, rouge) et de type II (Myosin Heavy Chain fast, DAB, marron) chez l’homme (E) et la truie (F) (grossissement X 10). Le sphincter de l’homme est composé exclusivement de fibres de type I alors que le sphincter de la truie contient les deux types de fibres. L’échelle est la identique pour les figures A, B, C, D.
A lire aussi