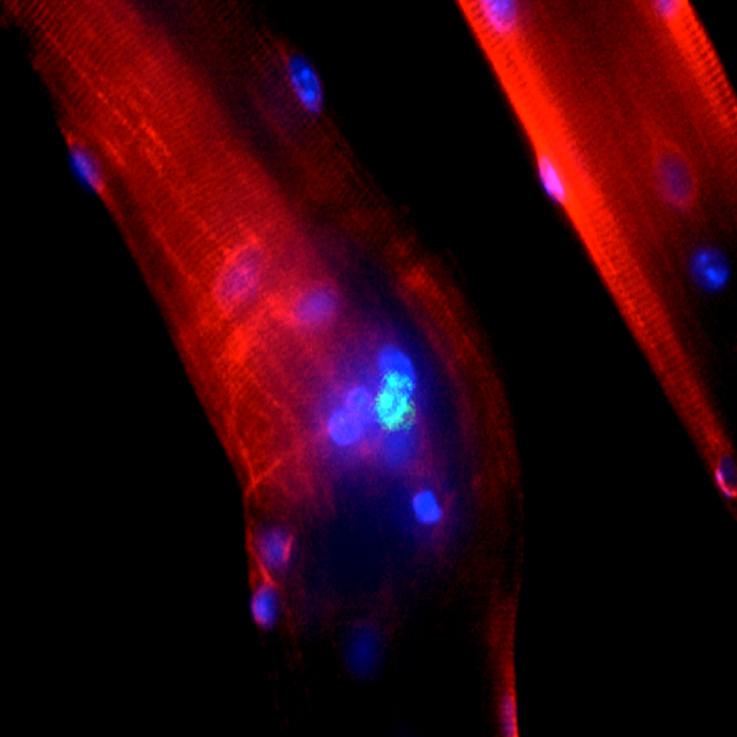
Cette vidéo montre une fusion partielle entre une cellule souche hMADS et une cellule souffrante (coloration verte) par un pont (nanotube). Par cette connexion, la cellule souche hMADS transfère des mitochondries (colorées en rouge) -principale source d'énergie cellulaire- à la cellule souffrante.
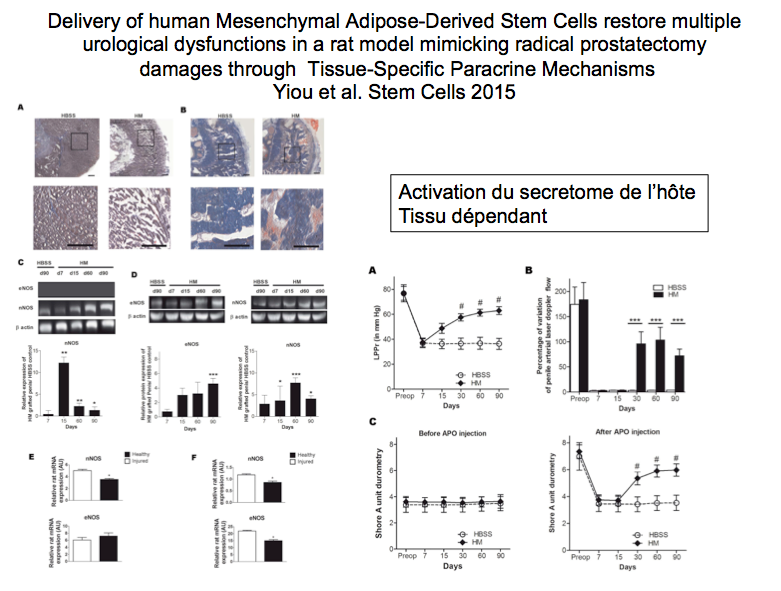
Nous avons montré (Yiou et al. Stem Cell 2015) que des cellules souches présente dans le tissu adipeux (cellules hMADS) injectées chez des rats présentant à la fois une incontinence urinaire et un trouble de l’érection vont non seulement produire des facteurs solubles permettant de régénérer ces deux tissus mais aussi transmettre aux cellules lésées de chaque tissu une capacité à s’auto-régénérer (probablement par transfert de mitochondries). Par ailleurs, l’action des cellules hMADS s’adapte à la nature de la lésion et au tissu dans lequel elles se trouvent. Il s’agit à notre connaissance de la première description de ce type d’ « intelligence » cellulaire.
Le laboratoire dirigé par le Dr Rodriguez (Equipe 8, IMRB, CHU Henri Mondor) a récemment montré que le tissu adipeux humain contient une population de cellules souches mésenchymateuses non immunogènes, dotées d’un potentiel d’auto renouvellement et de plasticité proche des cellules souches embryonnaires (plasticité in vitro et in vivo, caryotype normal, persistance de l’activité télomérase en culture, entrée spontanée en quiescence in vitro, absence de formation tumorale). Ces cellules appelées hMADS (« human Multipotent Adipose Derived Stem Cells ») font actuellement l’objet de recherches approfondies dans plusieurs domaines de la médecine régénérative. Une phase de recherche préclinique est en cours chez le cochon pour le traitement de l’infarctus du myocarde. Il a été montré que les cellules hMADS injectées chez la souris et le cochon sans immunosuppression préalable ne sont pas rejetées et réparent des lésions complexes expérimentales du muscle squelettique et du muscle cardiaque. Leur mécanisme d’action est multifactoriel et est actuellement étudié dans notre laboratoire. Plusieurs modes d’action ont ainsi été observés: 1) transdifférentiation spontanée des cellules hMADS en les cellules déficientes du receveur, 2) fusion des cellules hMADS avec les cellules lésées permettant une reprogrammation des cellules somatiques par transfert de matériel génétique, 3) recrutement de cellules progénitrices locales, 4) fusion partielle par nanotubes et inhibition de l’apoptose par transfert de mitochondries, 5) production de facteurs neurotrophiques et angiogéniques par les cellules hMADS.
Cette vidéo résume les mécanismes d'action potentiels des cellules souches.
En urologie, les cellules souches issues du tissu adipeux (lipoaspirats) ont précédemment été testées avec des résultats encourageants aussi bien dans des modèles animaux de dysfonction érectile par lésion des nerfs caverneux (Albersen, Fandel et al. 2010) que dans des modèles d’incontinence urinaire (Jack, Almeida et al. 2005). Une action paracrine favorisant la repousse des nerfs caverneux a ainsi été démontrée par l’équipe du Dr T. Lue (Albersen, Fandel et al. 2010).
Nous avons testé en allogénique et dans un modèle animal chez le rat reproduisant à la fois une séquelle urinaire et sexuelle de la prostatectomie radicale la multipotentialié des cellules souches hMADS du tissu adipeux.
Nous avons constaté un mois post-injection cellulaire une récupération de 80% des valeurs du flux doppler laser pénien et de la rigidité du pénis et 50% de la pression intraurétrale (Leak Point Pressure retrograde) alors que ces fonctions sont restées abolies chez le rats lésés et traités par placebo. Ces greffes cellulaires ont été réalisées immédiatement après la lésion et ont probablement agi en inhibant l’apoptose causée par la lésion.
Le mécanisme d’action des cellules hMADS a pu être mis en évidence. Pour la première fois, nous avons constaté que les cellules hMADS, immédiatement après avoir été injectées dans le sphincter urétral lésé ou le pénis produisent un grand nombre de facteur de croissance nerveuse et vasculaire favorisant la réparation des lésions induites. Nous avons de plus pu montrer que ces cellules transmettaient cette propriété de secréter ces facteurs de croissance aux cellules de l’hôte, pérennisant ainsi le mécanisme de régénération. Ce mécanisme d’action décrit pour la première présente d’autre par la caractéristique de pouvoir s’adapter en fonction de l’environnement et du type de lésion à réparer.
Au total, les cellules hMADS, injectées chez des rats présentant à la fois une incontinence urinaire et un trouble de l’érection, vont non seulement produire des facteurs solubles permettant de régénérer ces deux tissus mais aussi conférer aux cellules lésées dans chaque tissu une capacité à s’auto-régénérer (probablement par transfert de mitochondries). L’action des cellules hMADS s’adapte à la nature de la lésion et au tissu dans lequel elle se trouve.
Ce travail à fait l'objet d'une publication dans le revue Stem Cell: Yiou R, Mahrouf-Yorgov M, Trébeau C, Zanaty M, Lecointe C, Souktani R, Zadigue P, Figeac F, Rodriguez AM. Delivery of human mesenchymal adipose-derived stem cells restores multiple urological dysfunctions in a rat model mimicking radical prostatectomy damages through tissue-specific paracrine mechanisms. Stem Cells. 2015 Oct 6. doi: 10.1002/stem.2226. [Epub ahead of print] PubMed PMID: 26439006.
A lire aussi
A lire aussi