La technique de greffe intra urétrale de cellules précurseurs musculaire (CPM) présentée est celle qui a fait l’objet des essais cliniques BTH0605 et IPSMA.
Principes biologiques du transfert intra-urétral de CPM par implantation de fibres musculaires. Hypothèses testées.
Les cellules satellites, principales cellules précurseurs musculaires (CPM), sont actuellement définies par leur position entre la membrane plasmique et la lame basale des fibres (Collins, Olsen et al. 2005). Après une lésion musculaire, ces cellules sont activées (prenant alors le nom de myoblastes), prolifèrent puis fusionnent pour former de nouvelles fibres musculaires (myotubes) ou réparer les dommages subis par leur fibre parentale. Bien que le nombre de cellules satellites présentes à l’état basal dans un muscle soit très faible, il est suffisant pour permettre une régénération ad intergrum des fibres perdues après une lésion (Zammit, Heslop et al. 2002). Par ailleurs, il est maintenant établi que les fibres musculaires elles-mêmes et leur matrice extracellulaire jouent un rôle dans le processus de régénération musculaire notamment en relargant des facteurs de croissance lors de la phase de dégénérescence. Certaines cytokines ont ainsi une action neutrophique capable d’induire un bourgeonnement des terminaisons nerveuses avoisinantes (English 2003) et/ou favoriser l’angiogenèse (Lefaucheur, Gjata et al. 1996).
Nous avons considéré une méthode de transfert intra urétral de cellules satellites consistant à implanter, immédiatement après leur prélèvement, des fibres musculaires avec leurs cellules satellites, sans phase d’extraction ni de culture cellulaire. Nous avons testé les hypothèses suivantes :
- L’implantation directe de fibres musculaires dans la paroi urétrale entraîne un processus myogénique avec une phase de dégénérescence musculaire et d’activation des cellules satellites ; puis celles-ci fusionnent pour remplacer les fibres musculaires parentales. La membrane basale de chaque fibre musculaire pourrait avoir la fonction de tube-guide orientant le processus de fusion des cellules satellites.
- L’implantation de fibres musculaires a une action neurotrophique sur le système nerveux urétral. Les fibres musculaires contiennent des facteurs de croissance nerveuse qui sont libérés après une dénervation expérimentale et favorisent leur réinnervation (neuroleukine, insulin-like growth factor) (English 2003); l’implantation de fibres musculaires dans la paroi urétrale pourrait donc exercer une action neurotrophique sur l’environnement urétral (ici le prélèvement constitue par définition une lésion de dénervation+dévascularisation). Cette hypothèse a été étudiée par les Docteurs Swieb et Lecoeur : en particulier, nous avons cherché à mettre en évidence un relargage de facteurs neurotrophiques dans l’urètre après implantation de fibres musculaires et à déterminer si les myotubes résultants de l’implantation de fibres étaient innervés. A l’aide du modèle d’incontinence urinaire décrit chez la truie, nous avons étudié l’effet de la curarisation sur les modifications de pression intra urétrale induites par l’implantation de fibres. Ces expériences ont été élaborées pour différencier une véritable action musculaire tonique sous commande nerveuse d’un effet de comblement de la paroi urétrale (a priori non modifié par l’injection de curare).
- L’absence d’extraction enzymatique et de culture cellulaire permet de préserver le potentiel myogénique des cellules satellites. Nous avons testé cette hypothèse en comparant les résultats de greffes de CPM préparées selon des conditions différentes : absence ou réalisation d’une extraction enzymatique des cellules satellite et/ou d’une phase de culture cellulaire. Ce travail a fait l’objet de la thèse du Dr Laurent Zini.
Preuve du concept : la greffe de carottes de fibres musculaires avec cellules satellites aboutit à un processus myogénique « dirigé » dans la paroi urétrale (direction du travail effectué par le Dr Constant Lecoeur)
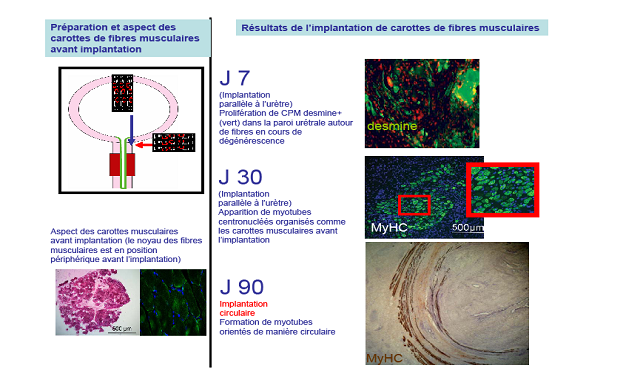
Pour cette série d’expériences préliminaires, nous avons implanté dans la paroi urétrale des carottes de fibres musculaires (environ 1,6 mm de diamètre). L’implantation a été réalisée à la seringue montée d’une aiguille dans l’urètre proximal dont la paroi est exclusivement constituée de muscle lisse. Nous avons choisi ce site d’implantation, situé à 3 cm du sphincter strié, afin de pouvoir utiliser des anticorps spécifiques des muscles striés (anti-Myosin Heavy Chains) pour retrouver les implants et détecter la formation de myotubes sur les coupes histologiques.
Nous avons utilisé la technique de marquage cellulaire (ici essentiellement les fibres musculaires) par nanoparticules ferriques pour repérer le site d’implantation par IRM et sur coupe histologique par la coloration de Perl’s (couleur bleue).
Le principal critère de régénération musculaire était la position des noyaux des fibres/myotubes. Ceux-ci sont situés en position périphérique dans un muscle non lésé ; après un processus de dégénérescence/régénération avec activation et fusion des cellules satellites, le noyau des fibres musculaires régénérées (myotubes) reste en position centrale (Sharp, Kornegay et al. 1993).
Résultats (figure):
A J+7 après l’implantation, une prolifération de cellules satellites était notée au site d’implantation autour de fibres nécrosées. A J+30, les cellules satellites avaient fusionné pour former des myotubes centronuclés organisés en faisceaux dont l’orientation était identique à celle donnée aux fibres parentales, c'est-à-dire longitudinale ou circulaire. La quasi totalité des fibres implantées avait subit un processus de dégénérescence-régénération. Ainsi, ces expériences préliminaires ont montré que l’implantation de faisceaux de fibres musculaires dans la paroi urétrale aboutit, après une phase de dégénérescence/régénération, à la formation de myotubes organisés suivant l’architecture initiale de la carotte. Ce résultat conforte la notion que chaque fibre musculaire entourée de sa membrane basale et de ses cellules satellites constitue une sorte d’ «unité régénératrice » capable de contrôler le processus de prolifération et de différenciation des cellules satellites. L’absence de formation de myotubes en dehors des sites d’implantation, montre que l’action régénératrice des cellules satellites se limite au remplacement de leur fibre parentale. Nous pensons que la membrane basale et la matrice extra cellulaire entourant chaque fibre joue un rôle fondamental dans la régulation de la prolifération des cellules satellites.
Figure

Mise en évidence de la formation de myotubes innervés et fonctionnels après implantation de fibres musculaires dans la paroi urétrale (étude du potentiel neurotrophique)
Après avoir montré la possibilité de transférer des cellules satellites actives dans l’urètre lisse par implantation de fibres musculaires, nous avons étudié les interactions entre les myotubes formés et le système nerveux urétral à l’aide du modèle de lésion sphinctérienne précédemment décrit.
Dans cette série d’expérience, nous avons augmenté la quantité de fibres implantées et celles-ci ont été positionnées de manière circulaire dans l’urètre afin de reproduire une structure musculaire anatomiquement proche d’un sphincter normal. Nous avons étudié les modifications de la pression intra urétrale générées par les myotubes.
Protocole expérimental
L’implantation a été effectuée un mois après destruction endoscopique (électrocoagulation) du sphincter strié urétral (J0) qui est situé autour du tiers distal de l’urètre. Des bandelettes musculaires de 5 cm (longueur) x 2 mm (épaisseur) x 1 cm (largeur) ont été préparées à partir d’une biopsie de muscles du cou, puis implantées dans la portion proximale de l’urètre dénuée de cellules musculaires striées. Les implants ont été disposés dans la paroi urétrale perpendiculairement à l’axe de l’urètre de manière à ce que leurs fibres soient orientées circulairement.
Un bilan urodynamique avec mesure de la pression intra urétrale (pression de clôture) a été effectué systématiquement avant et après la lésion et un mois après la greffe de fibres musculaires ou de tissu graisseux. Les mesures étaient répétées 15 min après injection IV de curare afin de bloquer les jonctions neuromusculaires de toutes les fibres musculaires striées innervées présentes dans l’urètre (cf. figure 2).
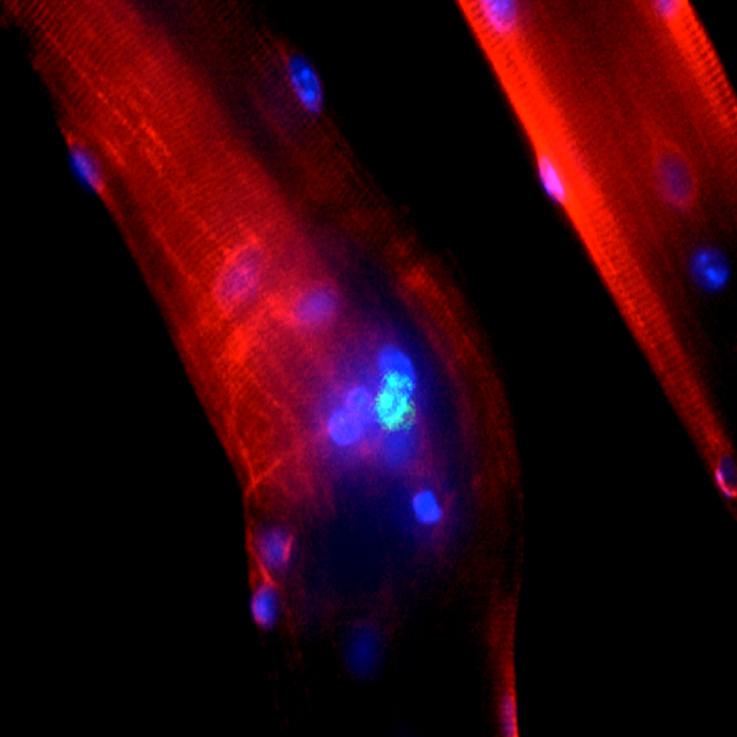
Les animaux ont été sacrifiés après le bilan urodynamique +/- IRM et les urètres ont été prélevés pour analyse histologique. Sur des coupes d’urètre congelé, nous avons étudié la présence de nanoparticules ferriques (coloration de Perl’s), terminaisons nerveuses (anticorps anti-neurofilament, PGP9,5, VAChT), cellules satellites activées (J7) (desmine) et de myotubes centronuclés (J30) (DAPI, anticorps anti-Myosin Heavy Chain). Nous avons étudié le type des fibres régénérées par immunofluorescence (anticorps anti-Myosin Heavy Chain de type I (slow) et II (fast)) et coloration histologique (NADH).
Résultats
Nous avons mis en évidence dans l’urètre proximal des truies greffées la présence de cellules satellites activées entourant des fibres musculaires en voie de dégénérescence à J+7. A J+30, des myotubes centronucléés étaient présents au site d’injection et étaient organisés sous forme de faisceaux circulaires. La localisation des cellules satellites et des myotubes coïncidait avec les aires contenant des nanoparticules ferriques.
En moyenne, 82%-18% des myotubes étaient de type II/I quelle que soit l’origine du muscle donneur. La coloration NADH était fortement positive, suggérant une activité tonique intermédiaire.
Le co-marquage nerf/plaque motrice sur une coupe donnée montrait que 30% des myotubes avaient un récepteur cholinergique connecté à une terminaison nerveuse (figure 6). La densité des fibres nerveuses était nettement plus dense au voisinage des myotubes que dans les autres parties de l’urètre.
Un mois après l’implantation de fibres, nous avons observé lors de la réalisation du bilan urodynamique une augmentation de la pression dans l’urètre proximal qui n’était jamais présente avant la lésion ou dans le groupe témoin (figure 7). Ce pic de pression était aboli après curarisation de l’animal puis réapparaissait une heure plus tard (délai d’élimination des curares) suggérant que l’action des myotubes sur l’urètre était de type tonique et sous commande nerveuse et ne correspondait pas à un simple effet de comblement.
Les modifications urodynamiques constatées à J+90 après l’implantation étaient identiques à celles observées à 1 mois avec une persistance des myotubes.
Ces travaux ont fait l’objet d’une publication parue dans la revue Journal of Urology (Lecoeur, Swieb et al. 2007).
FIGURE 6. Mise en évidence de la formation de myotube innervés dans la paroi de l’urètre proximal après implantation de fibres avec leurs cellules satellitesA, B : immunomarquage de la Myosin Heavy Chain de type II en coupe longitudinale (A) et transversale (B) au tiers proximal de l’urètre, un mois après implantation de fibres musculaires. Sur cette dernière incidence, les myotubes apparaissent centronucléés (coloration des noyaux avec du DAPI, bleu) : double immunomarquage VAChT (Texas red, rouge) et Myosin Heavy Chain II (FITC, vert). Des faisceaux de fibres nerveuses se développaient au contact des myotubes. D : double marquage neurofilament (Texas red, rouge) et bungarotoxine (vert) montrant une fibre nerveuse (flèches blanches) connectée à une plaque motrice sur un myotube (flèche noire). Grossissement initial : A, C : X 10 ; B : X 20 ; D : X 40.
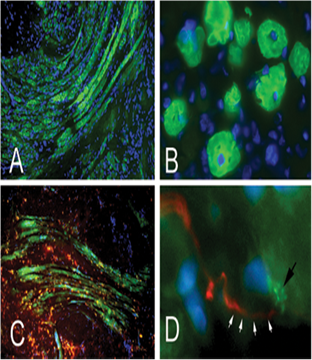
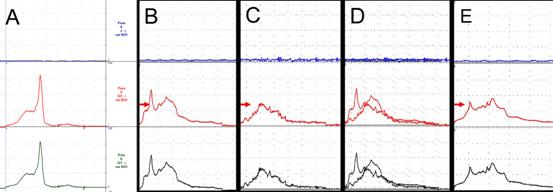
FIGURE 7. Etude urodynamique (profil de pression intra urétrale)
A : aspect d’une profilométrie urétrale normale montrant un pic de pression dans l’urètre distal correspondant à l’activité du sphincter strié urétral. (Courbe bleue : Pression vésicale, courbe rouge : Pression intra urétrale, courbe verte : Pression de clôture définie par P urétrale - P vésicale).
B : après destruction du sphincter strié et implantation de fibres dans l’urètre proximal, on note une augmentation de la pression urétrale en regard du site d’injection (B, flèche rouge). Ce pic de pression est aboli après injection de curare (C) et réapparaît une heure plus tard (E) démontrant qu’il correspond à une réelle activité tonique musculaire sous contrôle nerveux et non à un simple effet de volume. D : superposition des figures B et C.
Etude des facteurs neurotrophiques impliqués dans la régénération nerveuse après implantation de fibres avec cellules satellites (figure 8)
Nous avons quantifié par Western Blot le relargage de facteurs potentiellement neurotrophiques (CNTF, IGF 1 et IGF 2) par les cellules musculaires implantées dans l’urètre. Ces facteurs sont impliqués dans le bourgeonnement neuronal musculaire lors de lésion de dénervation expérimentale (English 2003).
Plusieurs groupes ont ainsi été étudiés :
- Urètres non lésés sans injection de cellules musculaires (groupe témoin).
- Implantation de fibres musculaires et cellules satellites (n=4).
- Implantation de cellules satellites extraites par digestion enzymatique non cultivées (n=4).
- Injection de cellules satellites extraites par digestion enzymatique et cultivées 5 jours (n=4).
Nous avons constaté que l’implantation de fibres musculaires avec cellules satellites entraîne une augmentation significative de la concentration en IGF1, IGF2 et CNTF dans la paroi urétrale à J7 en comparaison des autres types de greffe. Ces facteurs neurotrophiques n’étaient pas détectés dans les urètres non lésés.
Comparaison de trois méthodes de transfert intra urétral de CPM : étude des effets de la digestion enzymatique et de la culture préalable sur la survie cellulaire
Afin de d’étudier les effets de la préparation des CPM (digestion enzymatique et culture cellulaire) sur leur potentiel myogénique in vivo nous avons testé 3 types de greffe intra urétrale de cellules autologues, un mois après une lésion endoscopique du sphincter:
- groupe 1 (n=4) : prélèvement d’un muscle du cou, extraction des CPM par digestion enzymatique et expansion en culture pendant un semaine avant l’injection dans l’urètre proximal (environ 108 cellules).
- groupe 2 (n=4) : prélèvement d’un muscle du cou, extraction des CPM par injection enzymatique et injection dans l’urètre sans phase de culture cellulaire (environ 107 cellules).
- groupe 3 (n=4) : prélèvement d’un muscle du cou dont les fibres musculaires ont été implantées avec leur cellules sans préparation enzymatique ni culture cellulaire.
(Expériences réalisées au CHU de Lille par le Dr Zini).
Les mêmes évaluations histologiques et fonctionnelles que celles précédemment décrites ont été réalisées.
Résultats: Nous avons constaté l’absence de formation de myotubes dans le groupe 1, la formation de rares fibres musculaires désorganisées dans le groupe 2 et une formation de larges faisceaux de myotubes dans le groupe 3. Cette étude nous a permis de conforter l’hypothèse selon laquelle la préparation des CPM est susceptible d’entraîner une altération majeure de leur potentiel myogénique. L’extraction enzymatique des cellules satellites de leurs fibres parentales s’associe à un plus faible rendement de la greffe et à la formation de myotubes désorganisés.
CONCLUSIONS GENERALES DE L’EXPERIMENTATION ANIMALE
Plusieurs approches de thérapie cellulaire de l’ISU par greffe intra-sphinctérienne de CPM ont été proposées. La méthode transfert intra urétral de CPM que nous avons développée constitue une innovation par rapport à une thérapie cellulaire classique pour les raisons suivantes : 1) elle ne comprend pas de phase d’amplification cellulaire ex vivo, ce qui simplifie considérablement la procédure par rapport à celle mise en œuvre par les autres investigateurs parce qu’elle peut être effectuée en un temps, sans recours obligatoire à un laboratoire de culture dédié. Bien que le nombre de CPM (cellules satellites) implantées soit très inférieur à celui utilisé avec une méthode de thérapie cellulaire conventionnelle (injection de CPM extraites du muscle puis cultivées), nous avons observé lors de nos études expérimentales que l’absence d’étape in vitro préserve le potentiel myogénique des cellules satellites et accroît la masse de tissu musculaire finalement reconstituée. Ces résultats sont concordants avec ceux de récentes études ; 2) elle permet de contrôler l‘orientation des myotubes, volontairement déterminée par le chirurgien puisqu’il y a préservation de la structure organotypique. Le développement des myotubes sous forme d’une couche musculaire circulaire autour de l’urètre potentialise leur action de clôture. Ce paramètre n’est pas maîtrisé lorsqu’on injecte une suspension de cellules satellites ; 3) l’implantation des fibres en zone para-sphinctérienne – et non pas dans le muscle lui-même, comme cela est indispensable lorsque l’on utilise une suspension cellulaire – permet de créer un sphincter surnuméraire et évite tout dommage supplémentaire du sphincter natif.
A lire aussi
REFRENCES
Collins, C. A., I. Olsen, P. S. Zammit, L. Heslop, A. Petrie, T. A. Partridge and J. E. Morgan (2005). "Stem cell function, self-renewal, and behavioral heterogeneity of cells from the adult muscle satellite cell niche." Cell 122(2): 289-301.
English, A. W. (2003). "Cytokines, growth factors and sprouting at the neuromuscular junction." J Neurocytol 32(5-8): 943-960.
Lecoeur, C., S. Swieb, L. Zini, C. Riviere, H. Combrisson, R. Gherardi, C. Abbou and R. Yiou (2007). "Intraurethral transfer of satellite cells by myofiber implants results in the formation of innervated myotubes exerting tonic contractions." J Urol 178(1): 332-337.
Lefaucheur, J. P., B. Gjata, H. Lafont and A. Sebille (1996). "Angiogenic and inflammatory responses following skeletal muscle injury are altered by immune neutralization of endogenous basic fibroblast growth factor, insulin-like growth factor-1 and transforming growth factor-beta 1." J Neuroimmunol 70(1): 37-44.
Sharp, N. J., J. N. Kornegay, R. J. Bartlett, W. Y. Hung and M. J. Dykstra (1993). "Notexin-induced muscle injury in the dog." J Neurol Sci 116(1): 73-81.
Zammit, P. S., L. Heslop, V. Hudon, J. D. Rosenblatt, S. Tajbakhsh, M. E. Buckingham, J. R. Beauchamp and T. A. Partridge (2002). "Kinetics of myoblast proliferation show that resident satellite cells are competent to fully regenerate skeletal muscle fibers." Exp Cell Res 281(1): 39-49.