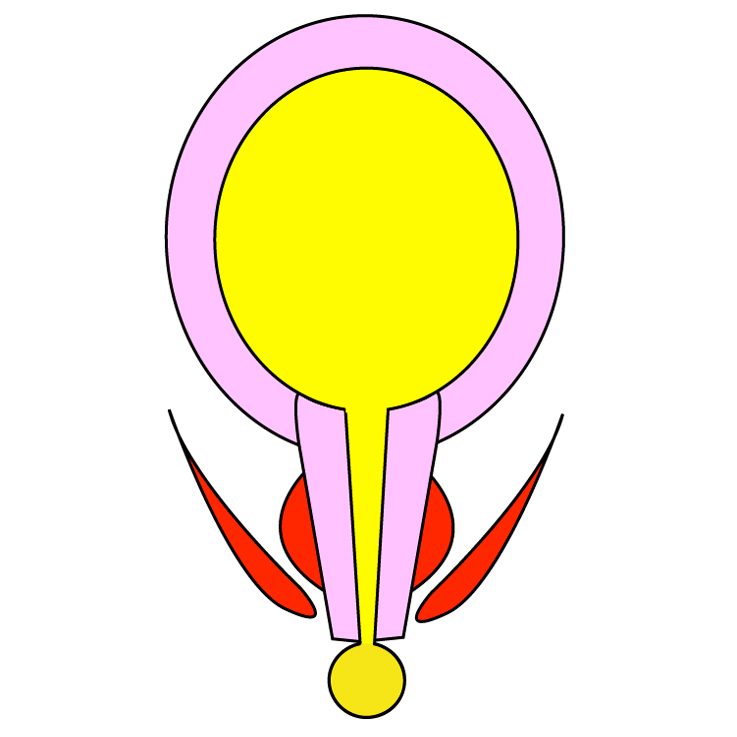
FIGURE 1. Mécanisme de la continence urinaire chez la femme.
FIGURE 1. Mécanisme de la continence urinaire chez la femme.
A : les muscles élévateurs de l’anus (ea) et le sphincter strié urétral (ssu) sont responsables de la continence urinaire à l’effort. Le sphincter strié urétral est innervé par le nerf pudendal (np). La continence urinaire nécessite une vessie (ve) compliante. Celle-ci reçoit son innervation du système végétatif sympathique et parasympathique provenant des plexus hypogastriques (ph) inférieurs et supérieurs. Il existe des connections nerveuses entre le muscle vésical et l’urètre à un niveau central et périphérique qui permettent de coordonner leurs actions.
B : la vagin (va), le muscle élévateur de l’anus (ea) et l’aponévrose pelvienne (ap) qui le recouvre participent à la constitution du plancher urétral. L’arcus tendineus du fascia pelvien (atfp) est un épaississement de l’aponévrose pelvienne qui amarre le vagin et l’urètre au muscle élévateur de l’anus.
C, D : reconstruction 3D (vue endopelvienne) du muscle élévateur de l’anus (ea) à partir de séquences d’IRM réalisées chez une patiente continente (C) et incontinente par hypermobilité vésico-urétrale (D) (images obtenues sur le site : splweb.bwh.harvard.edu). En cas d’incontinence, on note un décrochage (flèche verte) de l’insertion latérale du muscle élévateur de l’anus sur le muscle obturateur interne (oi) à l’origine de l’hypermobilité vésico-urétrale.
Rappels anatomiques et physiologiques sur la continence urinaire et l’appareil sphinctérien urétral
Bases anatomiques de la physiologie vésico-sphinctérienne
La continence urinaire est le résultat d’un équilibre entre la pression intra-vésicale et la pression intra-urètrale. Elle dépend d’un système neuro-musculaire complexe. Pendant la phase de remplissage vésical, la pression urétrale reste supérieure à la pression vésicale chez le sujet continent. Lors d’efforts mettant en jeu les muscles de l’abdomen, la pression vésicale augmente avec le risque théorique d’apparition de fuites urinaires. Le maintien de la continence à l’effort peut s’expliquer par plusieurs mécanismes :
-
La théorie de la transmission des pressions abdominales à l'urètre, popularisée en 1961 par Enhorning (Enhorning, 1961, 1976), postule que la vessie et la partie initiale de l'urètre sont situées dans une même enceinte abdominale fermée en bas par le plancher pelvien. Toute augmentation de la pression abdominale est intégralement transmise à la vessie et l’urètre avec, par conséquent, le maintien du gradient de pression vésico-urétrale garantissant la continence urinaire. Cette transmission ne se produit plus lorsque la base vésicale passe sous le plan des muscles élévateurs de l’anus à la faveur d'un prolapsus antérieur. Selon cette théorie, la fixation du col vésical est une condition essentielle de la continence, et sa mobilité est la cause principale de l'incontinence.
-
Les travaux de DeLancey ont proposé une hypothèse différente - la théorie du hamac - en montrant que l’urètre repose sur un plancher actif constitué par le vagin amarré latéralement au muscle élévateur de l’anus par l’aponévrose pelvienne (DeLancey, 1988, 1994). L’urètre est par ailleurs fixé au pubis par les ligaments pubo-urétraux et latéralement par un épaissement de l’aponévrose pelvienne, l’arcus tendineus du fascia pelvien (figure 1). Lors d’une augmentation brusque de la pression abdominale, la contraction du muscle élévateur de l’anus entraîne une mise en tension du fascia pelvien et du vagin qui font alors contre-pression sur l’urètre et le col vésical. Les faces antérieures et postérieures de l’urètre se trouvent alors comprimées entre les pressions abdominales et vaginales. Des études échographiques et neurophysiologiques ont illustré ces mécanismes actifs de la continence en montrant que la pression intra-urétrale augmente quelques millisecondes avant une brusque augmentation de la pression abdominale (DeLancey, 1997). Le défaut de soutien de l’urètre et de la vessie se manifeste cliniquement par une hypermobilité vésico-urétrale (incontinence urinaire de type II).
-
Le troisième élément participant à la continence urinaire à l’effort est représenté par les mécanismes intrinsèques à l’urètre. Ceux-ci sont représentés par la muqueuse urétrale richement vascularisée, le sphincter strié urétral et les fibres musculaires lisses urétrales et du col vésical.
Caractéristiques anatomiques et fonctionnelles de l’appareil sphinctérien urétral
Les cellules musculaires lisses urétrales
Les fibres musculaires lisses du col vésical et de l'urètre sont disposées en deux plans :
- une couche interne formant un mince manchon de fibres longitudinales qui prolongent celles du détrusor et du trigone ; leur contraction ouvre le col et raccourcit l'urètre.
- une couche externe faite de fibres circulaires ou obliques. Elles forment un système de frondes musculaires qui cravatent le col et s'enroulent autour de l'urètre. Classiquement, ces fibres se comportent comme un authentique sphincter, c'est-à-dire une structure annulaire indépendante ayant son innervation propre, capable de se contracter et de se relaxer pour assurer la fermeture ou l'ouverture du col et de l'urètre (McGuire et Woodside, 1981). Cependant, la rôle du col vésical dans la continence urinaire a été remis en question par plusieurs auteurs. Pour Gosling (1985), l’orientation des fibres musculaires lisses suggère que leurs contractions ouvrent plutôt que ne ferment le col vésical. Chapple et coll. (1989) ont montré que 21% des femmes continentes nullipares ont un col ouvert pendant des efforts de toux sans présenter de signe d’incontinence urinaire. Par ailleurs, le col vésical présente d’importantes variations en fonction du sexe. Chez l’homme, les cellules musculaires lisses du col vésical possèdent une innervation cholinergique et adrénergique plus riche et forment un anneau beaucoup plus épais que chez la femme (Dixon et coll., 1997). Les pressions cervicales au repos sont de l’ordre de 20 cm d’H2O et peuvent atteindre chez l’homme 500 cm d’H2O lors de l’éjaculation. Ceci laisse penser que le col vésical joue essentiellement un rôle lors de l’éjaculation. Par ailleurs, le faible taux d’incontinence urinaire après adénomectomie prostatique ou prostatectomie radicale est un argument supplémentaire en faveur d’un rôle accessoire du col vésical dans la continence. Chez la femme, la zone de pression urétrale maximale est située à hauteur du tiers moyen de l’urètre à l’endroit où se trouve le sphincter strié urétral et non en regard du col vésical. Les résultats de la cystectomie avec remplacement vésical chez la femme confirment le rôle de l’urètre moyen et du sphincter strié dans la continence urinaire (Stenzl et coll., 2001).
Le sphincter strié urétral
Le sphincter strié urétral est composé de fibres musculaires circulaires qui doublent extérieurement le manchon de cellules musculaires lisses urétrales. Des études récentes combinant dissection anatomique et IRM ont montré que le sphincter strié urétral est une entité anatomique distincte séparée des muscles du plancher pelvien par du tissu conjonctif (Dorchner et coll., 1999). Son anatomie est différente en fonction du sexe et de l’âge :
- chez la femme, il s'étend sur toute la longueur de l'urètre mais ne l'entoure complètement que dans son tiers moyen à l’endroit où la pression intra urétrale est la plus élevée (figure 2). Caudalement, le sphincter strié urétral n’est pas circulaire et ses fibres se terminent sur les faces latérales du vagin (muscle urétro-vaginal). Le sphincter strié urétral est complété par le muscle compresseur de l'urètre (faisceau profond du muscle bulbo-caverneux) qui s’insère latéralement sur les branches ischio-pubiennes, croise la face antérieure du méat pour se terminer en avant de l’urètre. Celui-ci est donc attiré en bas et en arrière lors de la contraction du muscle compresseur de l’urètre. DeLancey (1986) et Umek et coll. (2003) ont décomposé l’urètre féminin en cinq segments de taille équivalente : le premier segment est entouré par le col vésical. Les sphincters striés et lisses entourent les deux segments suivants, le muscle compresseur de l’urètre entoure le quatrième segment et le dernier segment est composé de tissu fibreux.
- chez l'homme, la prostate refoule les fibres du sphincter strié au cours de son développement à la puberté. A l’âge adulte, les fibres musculaires sphinctériennes entourent l'urètre membraneux et s’étalent autour de l’apex prostatique et sur les faces antérieures et latérales de la prostate. Le muscle élévateur de l'anus qui, chez l'homme, est en contact étroit avec l'urètre membraneux, joue un rôle sphinctérien, par sa contraction active, volontaire, qui permet aux sujets incontinents après une prostatectomie radicale d'interrompre leur miction.
On distingue, dans le sphincter strié, deux parties avec des fibres différentes par leur origine, leur structure et peut-être aussi leur innervation et leur fonction. Classiquement, la portion para-urétrale, dans la paroi même de l'urètre, est formée exclusivement de fibres de type I (Gosling et coll., 1981), à contraction lente, développant une activité tonique. La portion péri-urétrale appartient aux muscles du plancher pelvien (en particulier la composante pubo-coccygienne de l'élévateur de l'anus) et contient des fibres à contraction rapide (type II) capables de produire une compression volontaire (interruption du jet) ou réflexe (augmentation soudaine de la pression intra-abdominale) de l'urètre. Il existe une certaine plasticité des fibres striées sphinctériennes avec une transformation possible des fibres de type II en fibres de type I par la rééducation pelvi-périnéale (Bazeed et coll., 1982b).
Chaque composante de la paroi urétrale (muqueuse, sphincter strié et muscle lisse) contribue à développer la pression intra-urétrale qui doit rester supérieure à la pression intra-vésicale pour garantir la continence. La participation effective de chacun de ces éléments dans la pression de clôture urétrale est encore débattue. Le blocage de l’activité du sphincter strié urétral avec les agents de blocage neuromusculaire nicotinique (curare) réduit le tonus urétral d’environ 33% (Rud et coll., 1980). Chez le chien, la section des plexus hypogastriques diminue la pression urétrale de 46% sans modifier la pression dans l’urètre distal autour duquel se trouve le sphincter strié urétral. La section bilatérale du nerf pudendal abaisse la pression à ce niveau de près des 2/3 (Ali-el-dein et coll., 2001).
Innervation du sphincter strié urétral
L'appareil vésico-sphinctérien reçoit une innervation sympathique, parasympathique et somatique. Il existe de nombreuses connections centrales et périphériques entre ces différents systèmes qui assurent leur coordination lors de la miction et de la phase de remplissage vésical.
Le sphincter strié urétral est essentiellement innervé par le nerf pudendal. Celui-ci naît du plexus pudendal, constitué par la réunion des deuxième, troisième et quatrième nerfs sacraux puis quitte le bassin et y revient, après avoir contourné l'épine ischiatique ; il longe ensuite la paroi latérale de l’étage inférieur de la fosse ischio-rectale, dans un dédoublement de l'aponévrose du muscle obturateur interne, le canal pudendal, au contact du prolongement falciforme du ligament sacro-tubéral. Un contingent de fibres nerveuses somatiques destinées au sphincter strié urétral pourrait avoir un trajet sus-lévatorien et constituer une voie nerveuse motrice accessoire (Arango et coll., 2000 ; Borirakchanyavat et coll., 1997a).
Le centre somatique sacré se situe dans le noyau d'Onuf, dans la corne antérieure de S2 à S4. Deux centres ont été identifiés dans le tronc cérébral. La stimulation du centre médian (M), décrit par Barrington, reproduit une miction réflexe qui débute par une relaxation sphinctérienne suivie, en moins de 2 secondes, d'une contraction vésicale. Le centre latéral (L) est connecté avec les cellules du noyau d'Onuf. Sa stimulation induit une forte contraction sphinctérienne et périnéale. Le centre cérébral du contrôle volontaire est l'aire somatomotrice (ou précentrale), située dans le gyrus précentral. Le noyau d’Onulf reçoit également des informations de l’hypothalamus, des neurones sérotoninergiques du raphé et de neurones adrénergiques bulbo-spinaux.
Le nerf pudendal est un nerf complexe qui contient à la fois des fibres somatiques et végétatives (Bradley et Teague,1977 ; Dail et coll., 1999 ; Colombel et coll., 1999). La nature des fibres nerveuses impliquées dans la commande du sphincter strié urétral est encore controversée. Pour certains auteurs, le système végétatif pourrait moduler les contractions du sphincter strié urétral (Kakizaki et coll., 1991 1994) : chez le chat, la stimulation des nerfs hypogastriques (système nerveux autonome) déclenche des potentiels myogéniques dans le sphincter strié urétral qui persistent après blocage α-adrénergique. Ceci indique qu’il s’agit probablement de potentiels issus des fibres musculaires striées et non de cellules musculaires lisses qui pourraient être présentes dans le sphincter strié. Les particularités embryologiques du sphincter strié urétral (voir chapitre « Etat des connaissances », paragraphe 3.4) et les étroites relations anatomiques et fonctionnelles avec le muscle lisse urétral sont probablement à l’origine de cette innervation complexe et inhabituelle pour un muscle strié.
Il existe de nombreuses connections à l’étage périphérique et central entre le système nerveux végétatif vésical et somatique sphinctérien. Le système parasympathique induit une inhibition réciproque sur le système sympathique et somatique. Pendant la phase de remplissage, les neurones moteurs du sphincter strié sont activés par les afférents vésicaux. Le remplissage expérimental de la vessie s’accompagne d’une augmentation de l’activité EMG du sphincter strié urétral. Inversement, la contraction vésicale induit une relaxation sphinctérienne et la contraction volontaire du sphincter strié inhibe la contraction vésicale et le besoin d’uriner. Ce réflexe sacré peut être modulé par un contrôle supra-spinal facilité par l’activation des récepteurs sérotoninergiques.
Les principaux neurotransmetteurs impliqués dans le contrôle vésico-sphinctérien sont : l’acétylcholine (nerfs pelviens parasympathiques et nerf somatique pudendal), la norépinéphrine (nerfs hypogastriques sympathiques), la sérotonine, le glutamate, le GABA et la dopamine. Des travaux récents ont montré que la sérotonine et la norépinéphrine pourraient jouer un rôle majeur dans la modulation de la contraction du sphincter strié urétral. D’autres études ont mis en évidence l’existence de NOSynthase (monoxyde d’azote synthase) dans le sphincter strié urétral. Le NO est connu pour son implication dans la relaxation du muscle lisse. Son rôle dans le relâchement du sphincter strié urétral n’est pas encore clairement établi.
Le sphincter strié urétral reçoit donc une innervation complexe qui doit être prise en considération lors de la mise au point de tout traitement visant spécifiquement à augmenter son tonus urétral basal.
Incontinence urinaire et insuffisance sphinctérienne urétrale : définition, facteurs étiologiques, physiopathologie, épidémiologie et traitements
Définitions
L’incontinence urinaire est définie, selon l’International Continence Society (ICS), par « toute perte involontaire d’urine dont se plaint le patient» (Abrams et coll, 2003).
Chez la femme, les formes cliniques les plus fréquentes sont l’incontinence urinaire d’effort, l’incontinence urinaire par impériosité et l’incontinence urinaire mixte.
- l'incontinence urinaire d’effort est caractérisée par une fuite involontaire d’urine, non précédée du besoin d’uriner, qui survient à l’occasion d’un effort tel que toux, rire, éternuement, saut, course, soulèvement de charges ou toute autre activité physique augmentant la pression intra-abdominale,
- l’incontinence urinaire par impériosité est caractérisée par la perte involontaire d’urine précédée d’un besoin urgent et irrépressible d’uriner aboutissant à une miction ne pouvant être différée;
- l’incontinence urinaire mixte combine les deux types de symptômes, et souvent l’un des deux types de symptômes est plus gênant que l’autre pour la patiente.
Plusieurs types d’incontinence urinaire à l’effort peuvent être distingués. Une classification a été proposée en fonction de l’aspect radiologique de la jonction urétro-vésicale et de l’urètre. La perte de l’angle urétro-vésical postérieur constitue le type I (Haab et coll., 1996). Le type II est défini par l’association d’un prolapsus vésical et de l’urètre durant un effort augmentant la pression abdominale (hyper-mobilité vésico-urétrale). En 1980, McGuire et coll. introduisirent le concept d’incontinence urinaire de type III correspondant à l’insuffisance sphinctérienne urétrale. Ce type d’incontinence est particulièrement observé chez les patientes ayant subi plusieurs interventions chirurgicales pour une incontinence urinaire. Il se manifeste par un col vésical ouvert et un urètre immobile.
Facteurs étiologiques de l’insuffisance sphinctérienne urétrale
-
L’accouchement
L’accouchement par voie vaginale constitue l’un des principaux facteurs de risque d’incontience urinaire. Il peut favoriser une insuffisance sphinctérienne urinaire ou anale par une neuropathie d’étirement (Snooks et coll., 1986, 1984). Cependant, les effets directs de l’accouchement sur les fibres musculaires du périnée sont encore mal connus.
-
Antécédents de chirurgie pelvienne
Toute chirurgie abordant l’urètre est susceptible de léser les fibres musculaires sphinctériennes et/ou leur innervation. Chez l’homme, la survenue d’une incontinence urinaire est habituellement une séquelle de la chirurgie prostatique (adénome ou cancer de la prostate) (Ficazzola et Nitti, 1998 ; Comiter et coll., 1997, 2003 ; Gudziak et coll., 1996). Après prostatectomie radicale pour cancer, l’incontinence urinaire peut s’expliquer par : (i) une lésion directe du sphincter et/ou de son innervation, (ii) une diminution de la longueur fonctionnelle urétrale (Rudy et coll., 1984), (iii) une instabilité vésicale de novo.
-
Lésion neurologique
Une lésion neurologique centrale (lésion du cône médullaire ou des racines nerveuses S2, S3 and S4) ou périphérique peut être responsable de troubles vésico-sphinctériens. La chirurgie pelvienne (amputation abdomino-périnéale pour cancer du rectum, hystérectomie) peut entraîner une lésion des plexus hypogastriques pelviens à son tour responsable d’une insuffisance sphinctérienne urétrale.
-
Irradiation pelvienne pour cancer
Une irradiation musculaire à la dose de 16 Gy détruit les fibres musculaires, leurs terminaisons nerveuses et les cellules satellites intrinsèques responsables de la régénération musculaire (Wernig et coll., 2000). L’association d’une irradiation à une lésion directe du sphincter strié lors d’un traitement pour cancer de prostate est donc susceptible d’entraîner une lésion irréversible.
-
L’âge
L’incidence de l’insuffisance sphinctérienne urétrale augmente avec l’âge (Parazzini et coll., 2000 ; Ballanger et Rischmann, 2000). Ceci s’explique par le fait que la muqueuse urétrale et les muscles du plancher périnéal (sphincter compris) ont des récepteurs aux œstrogènes (Seidlova-Wuttke et coll., 2004). Le déficit hormonal lié à la ménopause pourrait ainsi être un facteur déclenchant de l’insuffisance sphinctérienne.
Par ailleurs, Strasser et coll. (1999) ont mis en évidence une majoration des phénomènes apoptotiques dans le sphincter strié urétral de femmes âgées, sans que l’origine de cette mort cellulaire n’ait pu être identifiée précisément.
-
Facteurs génétiques
Une prédisposition familiale a été mise en évidence chez les femmes incontinentes (Mushkat et coll., 1996) mais les anomalies génétiques s’y rapportant ne sont pas encore déterminées.
Anomalies histopathologiques associées à l’incontinence urinaire et à l’insuffisance sphinctérienne
L’incontinence urinaire d’effort de la femme, qu’elle soit secondaire à la dégradation des structures de soutien de l’urètre ou à une insuffisance sphinctérienne, est le résultat d’altérations neuromusculaires et conjonctives complexes. De nombreuses études histologiques et électrophysiologiques ont cherché à caractériser l’origine de cette dégradation. Mais les résultats énoncés sont parfois contradictoires et reflètent son caractère multifactoriel.
Les principales études électrophysiologiques ont mis en évidence des signes de dénervation partielle périnéale en cas d’insuffisance sphinctérienne anale ou d’incontinence urinaire après l’accouchement (Snooks et coll., 1986, 1984). La dénervation sphinctérienne se manifeste par une diminution des unités motrices électromyographiques avec absence de recrutement lors des contractions volontaires et par des potentiels de fibrillation au repos (Haab et coll., 1996). Prat-Pradal et coll. (1991) ont mis en évidence des lésions électromyographiques mixtes neuropathiques et/ou myopathiques chez des patientes ayant une insuffisance sphinctérienne urétrale.
Les études histologiques réalisées à partir de biopsies musculaires périnéales chez des femmes incontinentes ont fait état d’anomalies témoignant soit d’une atteinte primitivement myopathique dans le muscle élévateur de l’anus (Dimpfl et coll., 1998; Helt et coll., 1996) soit d’une atteinte neuropathique dans le sphincter strié urétral (Hale et al., 1999). Helt et coll. (1996) ont conclu à une absence de dénervation sur des biopsies de muscle élévateur de l’anus prélevées chez des femmes incontinentes ou présentant un prolapsus. Chen et coll. (2003) ont mis en évidence des signes de dénervation et une fibrose musculaire qui évoque une atteinte de type myopathique. Gilpin et coll. (1989) ont observé la présence de fibres nécrotiques et de fibres centronuclées témoignant d’un processus myopathique avec des phénomènes de régénération. Parks et coll. (1988) ont clairement mis en évidence des signes de dénervation chronique avec groupement de fibres et atrophies en coin dans le sphincter anal de patientes souffrant d’incontinence fécale. Enfin, une modification de la composition en collagène a été démontrée par certains auteurs (Goepel et coll., 2003 ; Ulmsten et coll.,1987).
Au total, l’origine de l’altération musculaire à l’origine d’une l’insuffisance sphinctérienne urétrale n’est pas clairement établie et varie probablement en fonction du sexe et de l’étiologie. Chez la femme, il pourrait s’agir d’une lésion d’étirement du nerf pudendal ou d’une atteinte primaire des fibres musculaires liée à un éventuel trouble métabolique ou génétique. Dans l’élaboration des différentes étapes de notre projet, nous avons cherché à développer une lésion sphinctérienne rassemblant les principales caractéristiques décrites plus haut avec absence de processus régénératif actif et une combinaison de signes neuropathiques et myopathiques.
A lire aussi